Harorat (Temperatura)
Harorat - bu issiqlik va sovuqlikni miqdoriy jihatdan ifodalovchi fizik miqdor . Harorat termometr yordamida o'lchanadi .
Termometrlar turli xil harorat shkalalarida sozlanadi, ular tarixan aniqlash uchun turli mos yozuvlar nuqtalari va termometrik moddalarga tayangan. Eng keng tarqalgan shkalalar birlik belgisi bo'lgan Selsiy shkalasi °C (avval santigrad deb ataladigan), Farengeyt shkalasi (°F) va Kelvin shkalasi (K), ikkinchisi asosan ilmiy maqsadlarda qo'llaniladi. Kelvin Xalqaro birliklar tizimidagi (SI) ettita asosiy birlikdan biri hisoblanadi.
Mutlaq nol, ya'ni nol kelvin yoki -273,15 °C, termodinamik harorat shkalasidagi eng past nuqta hisoblanadi. Eksperimental ravishda, termodinamikaning uchinchi qonunida ta'kidlanganidek, unga juda yaqin yondashish mumkin, lekin aslida erishilmaydi. Bunday haroratda tanadan issiqlik sifatida energiya olish mumkin emas.
Harorat tabiiy fanlarning barcha sohalarida, jumladan fizika, kimyo, astronomiya, tibbiyot, biologiya, ekologiya, materialshunoslik, metallurgiya, mashinasozlik va geografiya, shuningdek, kundalik hayotning ko'pgina jabhalarida muhim ahamiyatga ega.
Effektlar[tahrir | manbasini tahrirlash]
Ko'pgina fizik jarayonlar harorat bilan bog'liq bo'ladi; ulardan ba'zilari quyida keltirilgan:
- faza ( qattiq, suyuq, gazsimon yoki plazma ), zichlik, eruvchanlik, bug 'bosimi, elektr o'tkazuvchanligi, qattiqlik, aşınma qarshilik, issiqlik o'tkazuvchanligi, korroziyaga chidamlilik, kuch, jumladan, materiallarning fizik xususiyatlari;
- kimyoviy reaksiyalarning tezligi va darajasi [1]
- jism yuzasidan chiqadigan termal nurlanish miqdori va xossalari
- havo harorati barcha tirik organizmlarga ta'sir qiladi
- gazdagi mutlaq haroratning kvadrat ildiziga mutanosib bo'lgan tovush tezligi [2]
Shkalalar[tahrir | manbasini tahrirlash]
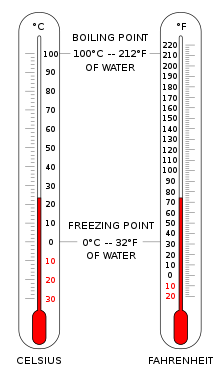
Tselsiy shkalasi (°C) dunyoning aksariyat mamlakatlarida umumiy haroratni o'lchash uchun ishlatiladi. Bu tarixan rivojlangan empirik shkala bo'lib, uning nol nuqtasi 0 °C ga olib keldi. 0 °C suvning muzlash nuqtasi sifatida belgilanadi va 100 °C suvning qaynash nuqtasi sifatida, ham dengiz sathida atmosfera bosimida . 100 graduslik interval tufayli u santigrad shkalasi deb ataldi. [3] Kelvin xalqaro birliklar tizimida standartlashtirilgandan beri u Kelvin shkalasi bo'yicha ekvivalent nuqtalar nuqtai nazaridan qayta aniqlandi, shuning uchun haroratning bir daraja Selsiyga ko'tarilishi bir kelvin o'sishi bilan bir xil bo'ladi. Raqamli shkalalar 273,15 ga aniq ofset bilan farqlanadi.
Farengeyt shkalasi Amerika Qo'shma Shtatlarda keng tarqalgan. Suv 32 °F da muzlaydi32 °F va 212 °F da qaynatiladi212 °FDengiz darajasidagi atmosfera bosimida 212 °F .
Mutlaq nol[tahrir | manbasini tahrirlash]
Mutlaq nol haroratda materiyadan issiqlik sifatida hech qanday energiya olib tashlanishi mumkin emas, bu termodinamikaning uchinchi qonunida ifodalangan. Bu haroratda moddada makroskopik issiqlik energiyasi mavjud emas, lekin noaniqlik printsipi tomonidan bashorat qilinganidek, kvant-mexanik nol nuqta energiyasiga ega, garchi bu mutlaq harorat ta'rifiga kirmaydi. Eksperimental ravishda mutlaq nolga faqat juda yaqin yondashish mumkin; unga hech qachon erishib bo'lmaydi (tajriba natijasida erishilgan eng past harorat 38 ga teng). pK). [4] Nazariy jihatdan, mutlaq nol haroratdagi jismda uning zarralarining barcha klassik harakati to'xtagan va ular bu klassik ma'noda to'liq harakat qila olmaydilar. Mutlaq nol, 0 K sifatida belgilangan 0 K, aynan −273.15 °C ga teng−273.15 °C yoki −459.67 °F .
Kelvin shkalasi[tahrir | manbasini tahrirlash]
Ko'pgina ilmiy o'lchovlar Kelvin harorat shkalasidan foydalanadi (birlik belgisi: K), uni birinchi marta aniqlagan fizik sharafiga nomlangan. Bu mutlaq o'lchovdir. Uning raqamli nol nuqtasi, 0 K, haroratning mutlaq nol darajasida. 2019-yil may oyidan boshlab kelvin zarralar kinetik nazariyasi va statistik mexanika orqali aniqlandi. Xalqaro birliklar tizimida (SI) kelvinning kattaligi Boltsman doimiyligi bo'yicha aniqlanadi, uning qiymati xalqaro konventsiya bilan belgilanadi. [5] [6]
Empirik shkalalar[tahrir | manbasini tahrirlash]
Empirik asoslangan harorat o'lchovlari to'g'ridan-to'g'ri materiallarning oddiy makroskopik fizik xususiyatlarini o'lchashga tayanadi. Misol uchun, shisha devorli kapillyar naychada joylashgan simob ustunining uzunligi asosan haroratga bog'liq va juda foydali simobli shisha termometrining asosi hisoblanadi. Bunday tarozilar faqat qulay harorat oralig'ida amal qiladi. Misol uchun, simobning qaynash nuqtasidan yuqorida, simobli shisha termometrni qo'llash mumkin emas. Ko'pgina materiallar haroratning oshishi bilan kengayadi, lekin ba'zi materiallar, masalan, suv, haroratning ma'lum bir diapazonda oshishi bilan qisqaradi va keyinchalik ular termometr sifatida deyarli qo'llanilmaydi. Materialdan o'zining faza o'zgarishi haroratidan biriga, masalan, qaynash nuqtasiga yaqin termometr sifatida foydalanilmaydi.
Nazariy ko'rsatgichlar[tahrir | manbasini tahrirlash]
Nazariy jihatdan asoslangan harorat shkalalari bevosita nazariy dalillarga, ayniqsa kinetik nazariya va termodinamika qonunlariga asoslangan. Ular amaliy jihatdan mumkin bo'lgan fizik qurilmalar va materiallarda ko'proq yoki kamroq ideal tarzda amalga oshiriladi. Nazariy jihatlarga asoslangan harorat o'lchovlari amaliy empirik asoslangan termometrlar uchun sozlash standartlarini ta'minlash uchun ishlatiladi.
Ideal gaz[tahrir | manbasini tahrirlash]
Makroskopik jihatdan aniqlangan harorat shkalasi asoslanishi mumkin bo'lgan material ideal gazdir. Ideal gazning qattiq hajmi va massasi tomonidan ta'sir qiladigan bosim uning haroratiga to'g'ridan-to'g'ri proportsionaldir. Ba'zi tabiiy gazlar mos harorat oralig'ida shunchalik deyarli ideal xususiyatlarga egaki, ular termometriya uchun ishlatilishi mumkin; bu termodinamikaning rivojlanishi davrida muhim bo'lgan va bugungi kunda ham amaliy ahamiyatga ega. Biroq, ideal gaz termometri nazariy jihatdan termodinamika uchun mukammal emas. Buning sababi shundaki, ideal gazning mutlaq nol haroratidagi entropiyasi musbat yarim aniq miqdor emas, bu gazni termodinamikaning uchinchi qonunini buzishga olib keladi. Haqiqiy materiallardan farqli o'laroq, ideal gaz qanchalik sovuq bo'lishidan qat'i nazar, suyuqlanmaydi va qotib qolmaydi. Shu bilan bir qatorda fikrlash, ideal gaz qonuni, cheksiz yuqori harorat va nol bosim chegarasiga ishora qiladi; bu shartlar tarkibiy molekulalarning interaktiv bo'lmagan harakatlarini ifoda etadi.
Agar issiqlik sig'imi aniq belgilangan miqdordagi modda uchun o'lchanadigan bo'lsa, o'ziga xos issiqlik bunday birlik miqdorining haroratini bir birlik haroratga oshirish uchun zarur bo'ladigan issiqlik miqdori o'lchovidir. Masalan, suv haroratini bir kelvinga (bir daraja Selsiyga teng) oshirish uchun har bir kilogramm (J/kg) 4186 joul energiya kerak bo'ladi.
O'lchov[tahrir | manbasini tahrirlash]

Tarixiy o'lchovlar[tahrir | manbasini tahrirlash]
- Kelvin shkalasi
- Tselsiy shkalasi
- Farengeyt shkalasi
- Rankine shkalasi
- Delisle shkalasi
- Nyuton shkalasi
- Réaumur shkalasi
- Romer shkalasi
Gazlarning kinetik nazariyasi[tahrir | manbasini tahrirlash]
Maksvell va Boltsman kinetik nazariyani ishlab chiqadi, bu esa gazlardagi haroratni tubdan tushunish imkonini beradi. [7] Bu nazariya, shuningdek, ideal gaz qonunini va bir atomli (yoki "asl" ) gazlarning kuzatilgan issiqlik sig'imini tushuntiradi. [8] [9] [10]
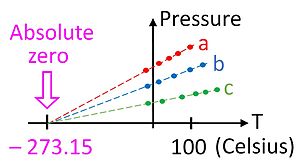
Ideal gaz qonuni bosim ( p ), hajm ( V ) va harorat ( T ) oʻrtasidagi kuzatilgan empirik munosabatlarga asoslanadi va gazlarning kinetik nazariyasi ishlab chiqilishidan ancha avval tan olingan (qarang Boyl va Charlz qonunlari). Ideal gaz qonunida aytiladi: [11]
Eslatmalar va havolalar[tahrir | manbasini tahrirlash]
- ↑ Agency, International Atomic Energy. Thermal discharges at nuclear power stations: their management and environmental impacts: a report prepared by a group of experts as the result of a panel meeting held in Vienna, 23–27 October 1972. International Atomic Energy Agency, 1974.
- ↑ Watkinson, John. The Art of Digital Audio. Taylor & Francis, 2001. ISBN 978-0-240-51587-8.
- ↑ Middleton, W.E.K. (1966), pp. 89–105.
- ↑ Joanna Thompson. „Scientists just broke the record for the coldest temperature ever recorded in a lab“ (en). livescience.com (2021-yil 14-oktyabr). Qaraldi: 2023-yil 28-aprel.
- ↑ Cryogenic Society (Wayback Machine saytida 2020-11-07 sanasida arxivlangan) (2019).
- ↑ Draft Resolution A "On the revision of the International System of Units (SI)" to be submitted to the CGPM at its 26th meeting (2018) (PDF), 2018-04-29da asl nusxadan (PDF) arxivlandi, qaraldi: 2019-10-20
- ↑ Swendsen, Robert (March 2006). "Statistical mechanics of colloids and Boltzmann's definition of entropy". American Journal of Physics 74 (3): 187–190. doi:10.1119/1.2174962. Archived from the original on 2020-02-28. https://web.archive.org/web/20200228234741/https://pdfs.semanticscholar.org/ff7b/6750c54750d9b13fa4d9adaeaf4b046bc7e6.pdf.
- ↑ Balescu, R. (1975). Equilibrium and Nonequilibrium Statistical Mechanics, Wiley, New York, ISBN 0-471-04600-0, pp. 148–154.
- ↑ Kittel, Charles. Thermal Physics, 2nd, W.H. Freeman Company, 1980 — 391–397 bet. ISBN 978-0-7167-1088-2.
- ↑ Kondepudi, D.K. (1987). "Microscopic aspects implied by the second law". Foundations of Physics 17 (7): 713–722. doi:10.1007/BF01889544.
- ↑ The Feynman Lectures on Physics. 39–5 The ideal gas law


