Koordinatsion son
Kimyo, kristallografiya va materialshunoslikda molekula yoki kristalldagi markaziy atomning koordinatsion soni, shuningdek, liganitsiya deb ham ataladi. Markaziy ion/molekula/atom atrofidagi ion/molekula/atom ligand deb ataladi. Bu raqam molekulalar uchun kristallarga qaraganda biroz boshqacha aniqlanadi.
Molekulalar va ko'p atomli ionlar uchun atomning koordinatsion raqami u bog'langan boshqa atomlarni hisoblash yo'li bilan aniqlanadi (bitta yoki ko'p bog'lanish orqali). Masalan, [Cr(NH 3) 2 Cl 2 Br 2 ] - markaziy kationi sifatida Cr 3+ ga ega, uning koordinatsion raqami 6 ga teng va heksakoordinata sifatida tavsiflanadi. Umumiy koordinatsion raqamlar 4, 6 va 8 dir.
Molekulalar, ko'p atomli ionlar va koordinatsion komplekslar[tahrir | manbasini tahrirlash]

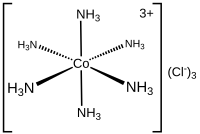

Kimyoda dastlab 1893-yilda Alfred Verner tomonidan aniqlangan koordinatsion raqam (C.N.) molekula yoki iondagi markaziy atomning qo'shnilarining umumiy sonidir.[2] Kontseptsiya ko'pincha muvofiqlashtirish komplekslariga nisbatan qo'llaniladi.
Oddiy va oddiy holatlar[tahrir | manbasini tahrirlash]
d guruppa o'tish metall komplekslari uchun eng keng tarqalgan koordinatsion raqam 6 ga teng. CN bunday komplekslarning geometriyasini farqlamaydi, ya'ni oktaedral va trigonal prizmatik.
O'tish metall komplekslari uchun koordinatsion raqamlar 2 dan (masalan, Ph 3 PAuCl da Au I) 9 gacha (masalan, [ReH 9 ] 2− da Re VII). f guruppa metallari (lantanoidlar va aktinoidlar) kattaroq ion radiuslari va bog'lanish uchun ko'proq orbitallarning mavjudligi tufayli yuqori koordinatsiya sonini sig'dira oladi. Odatda f -guruppa elementlari uchun 8 dan 12 gacha koordinatsion raqamlar kuzatiladi. Masalan, bidentat nitrat ionlari ligand sifatida Ce IV va Th IV 12 koordinatali ionlarni [Ce(NO 3) 6 ] 2− (serik ammoniy selitrasi) va [Th(NO 3) 6 ] 2− hosil qiladi. Atrofdagi ligandlar markaziy atomdan ancha kichik bo'lsa, undan ham yuqori koordinatsion raqamlar bo'lishi mumkin. Hisoblash kimyosi bo'yicha bir tadqiqot ayniqsa barqaror PbHe2+ ni bashorat qildiPbHe</br> PbHe ion 15 dan kam bo'lmagan geliy atomlari bilan muvofiqlashtirilgan markaziy qo'rg'oshin ionidan iborat.[3] Frank-Kasper fazalari orasida metall atomlarining o'rami 16 tagacha koordinatsion raqamlarni berishi mumkin.[4] Aksincha, sterik ekranlanish juda past koordinatsion raqamlarga olib kelishi mumkin. Koordinatsion raqami 1 bo'lgan metallning juda kam uchraydigan holati terfenilga asoslangan ariltaliy (I) kompleksi 2,6-Tipp 2 C 6 H 3 Tlda uchraydi, bu erda Tipp 2,4,6-triizopropilfenil guruhidir.[5]
Polihapto ligandlari[tahrir | manbasini tahrirlash]
Koordinatsion raqamlar polihapto ligandlari bilan ishlashda noaniq bo'lib qoladi. Siklopentadienid ioni [C 5 H 5 ] -, alkenlar va siklooktetraenid ioni [C 8 H 8 ] 2− kabi p-elektron ligandlar uchun p-elektron sistemasidagi markaziy atom bilan bogʻlangan qoʻshni atomlar soni. haptiklik deb ataladi. Ferrotsenda har bir siklopentadienid anionining haptikligi, ē, besh, Fe(ē 5 -C 5 H 5) 2 ga teng. Har bir siklopentadienid ligand tomonidan markaziy temir atomining koordinatsion raqamiga qo'shgan hissasini belgilashning turli usullari mavjud. Hissa bitta ligand bo'lganligi sababli bitta yoki qo'shni beshta atom mavjud bo'lganligi sababli beshta yoki uchta elektron juft ishtirok etganligi sababli uchta deb belgilanishi mumkin. Odatda elektron juftlar soni olinadi.[6]
Yuzaki va rekonstruksiya[tahrir | manbasini tahrirlash]
Koordinatsion raqamlar kristall panjaraning ichki qismidagi atomlar uchun yaxshi aniqlangan: barcha yo'nalishdagi eng yaqin qo'shnilarni sanash kerak. Ichki atomning qo'shnilari soni ommaviy koordinatsion raqam deb ataladi. Sirtlar uchun qo'shnilar soni ko'proq cheklangan, shuning uchun sirt koordinatsiya soni ommaviy muvofiqlashtirish sonidan kichikroq. Ko'pincha sirt koordinatsiya raqami noma'lum yoki o'zgaruvchan.[7] Sirt koordinatsiya soni ham sirtning Miller indekslariga bog'liq. Tana markazlashtirilgan kubik (BCC) kristalida massa koordinatsion soni 8 ga teng, (100) sirt uchun esa sirt koordinatsiya soni 4 ga teng.[8]
Keys tadqiqotlari[tahrir | manbasini tahrirlash]
Atomning koordinatsion sonini aniqlashning keng tarqalgan usuli bu rentgen kristallografiyasidir. Tegishli texnikalar neytron yoki elektron diffraktsiyasini o'z ichiga oladi.[9] Atomning koordinatsion raqamini eng yaqin qo'shnilarni sanash orqali to'g'ridan-to'g'ri aniqlash mumkin.
-alyuminiy muntazam kubikli yaqin o'ralgan tuzilishga ega, fcc, bu erda har bir alyuminiy atomining 12 ta eng yaqin qo'shnisi, 6 tasi bir xil tekislikda va 3 tasi yuqorida va pastda, koordinatsion ko'pburchak esa kuboktaedrdir. Temir tanasi markazlashtirilgan kubik tuzilishga ega bo'lib, har bir temir atomi kubning burchaklarida joylashgan 8 ta eng yaqin qo'shniga ega.

Uglerodning ikkita eng keng tarqalgan allotroplari turli xil koordinatsiya raqamlariga ega. Olmosda har bir uglerod atomi to'rtta boshqa uglerod atomlari tomonidan tashkil etilgan muntazam tetraedrning markazida joylashgan bo'lib, koordinatsion raqami metan uchun to'rtta. Grafit ikki o'lchovli qatlamlardan iborat bo'lib, unda har bir uglerod uchta boshqa uglerod bilan kovalent bog'langan; boshqa qatlamlardagi atomlar uzoqroqda joylashgan va eng yaqin qo'shnilar emas, koordinatsion raqam 3 ga teng[10]


Natriy xlorid va seziy xlorid kabi muntazam panjaralari bo'lgan kimyoviy birikmalar uchun eng yaqin qo'shnilarni hisoblash ionlarning muhiti haqida yaxshi rasm beradi. Natriy xloridda har bir natriy ioni eng yaqin qo'shni sifatida 6 xlorid ioniga ega (276 pm da) oktaedr burchaklarida va har bir xlorid ionida 6 ta natriy atomi mavjud (shuningdek, 276 pm da) oktaedrning burchaklarida. Seziy xloridda har bir seziy kubning burchaklarida joylashgan 8 ta xlorid ioniga ega (soat 356 da) va har bir xloridda sakkizta seziy ioni (shuningdek, 356 da) mavjud. pm) kubning burchaklarida.
Murakkabliklar[tahrir | manbasini tahrirlash]
Ba'zi birikmalarda metall-ligand bog'lari hammasi bir xil masofada bo'lmasligi mumkin. Misol uchun, PbCl 2 da Pb 2+ ning koordinatsion raqami qaysi xloridlar ligand sifatida tayinlanganiga qarab etti yoki to'qqizta deb aytish mumkin. Etti xlorid ligandlari Pb-Cl 280-309 masofaga ega pm. Ikki xlorid ligandlari uzoqroq, Pb-Cl masofalari 370. pm ga teng boʻladi[11]
Ba'zi hollarda koordinatsion raqamning boshqa ta'rifi qo'llaniladi, u eng yaqin qo'shnilarga qaraganda uzoqroq masofada joylashgan atomlarni o'z ichiga oladi. Xalqaro kristallografiya ittifoqi (IUCR) tomonidan qabul qilingan juda keng ta'rifda aytilishicha, kristall qattiq moddadagi atomning koordinatsion soni kimyoviy bog'lanish modeliga va koordinatsion raqamni hisoblash usuliga bog'liq.[12][13]
Ba'zi metallar tartibsiz tuzilishga ega. Misol uchun, sink buzilgan olti burchakli yaqin qadoqlangan tuzilishga ega. Sferalarning muntazam olti burchakli yaqin o'rami har bir atomning 12 ta eng yaqin qo'shnisi va uchburchak ortobikupol (shuningdek, antikuboktaedr yoki egizak kuboktaedr deb ataladi) koordinatsion ko'pyoqliga ega ekanligini taxmin qiladi.[10][14] Ruxda faqat 6 ta eng yaqin qo'shni 266 pm bir xil yaqin qadoqlangan samolyotda boshqa oltita, keyingi eng yaqin qo'shnilar bilan, teng masofada, uchtadan yuqorida va pastda 291 da yaqin o'ralgan samolyotlarning har birida. pm. Koordinatsion raqamni 6 emas, 12 deb ta’riflash maqsadga muvofiqdir[13] Shunga o'xshash mulohazalarni oddiy tana markazli kub tuzilishiga nisbatan qo'llash mumkin, bunda 8 ta eng yaqin qo'shnidan tashqari yana 6 ta, taxminan 15% uzoqroq,[10] va bu holda koordinatsiya soni ko'pincha 14 ga teng.

Ko'pgina kimyoviy birikmalar buzilgan tuzilishga ega. Nikel arsenid, NiAs nikel va mishyak atomlari 6-koordinatali bo'lgan tuzilishga ega. Xlorid ionlari kub shaklida joylashgan natriy xloriddan farqli o'laroq, mishyak anionlari olti burchakli yaqin o'ralgan. Nikel ionlari 6-koordinatali, buzilgan oktaedral koordinatsion ko'p yuzli bo'lib, bu erda oktaedr ustunlari qarama-qarshi yuzlarni taqsimlaydi. Mishyak ionlari oktaedral koordinatsiyaga ega emas, lekin trigonal prizmatik koordinatsion koʻpburchakka ega. Ushbu tartibning natijasi shundaki, nikel atomlari bir-biriga juda yaqin joylashgan. Ushbu tuzilishga ega bo'lgan boshqa birikmalar yoki chambarchas bog'liq bo'lgan FeS va CoS kabi ba'zi o'tish metall sulfidlari, shuningdek, ba'zi intermetalllar. Kobalt (II) tellurida, CoTe, oltita tellur va ikkita kobalt atomlari markaziy Co atomidan bir xil masofada joylashgan.[10]

Tez-tez uchraydigan kimyoviy moddalarning yana ikkita misoli Fe <sub id="mw1g">2</sub> O <sub id="mw1w">3</sub> va TiO <sub id="mw2Q">2</sub> dir. Fe 2 O 3 kristalli tuzilishga ega, uni oktaedral teshiklarning uchdan ikki qismini to'ldiradigan temir atomlari bilan yaqin joylashgan kislorod atomlari qatoriga ega deb ta'riflash mumkin. Biroq, har bir temir atomining 3 ta eng yaqin qo'shnisi va yana 3 tasi uzoqroqda joylashgan. Tuzilishi juda murakkab, kislorod atomlari to'rtta temir atomiga muvofiqlashtirilgan va temir atomlari o'z navbatida buzilgan oktaedrning uchlari, qirralari va yuzlarini bo'lishadi.[10] TiO 2 rutil tuzilishga ega. Titan atomlari 6-koordinatali, 198.3 da 2 atom pm va 4 da 194.6 pm, biroz buzilgan oktaedrda. Titan atomlari atrofidagi oktaedra uch o'lchovli tarmoqni hosil qilish uchun qirralar va uchlarini birlashtiradi. Oksid ionlari trigonal planar konfiguratsiyada 3-koordinatali.[15]
Kvazikristal, suyuq va boshqa tartibsiz tizimlarda foydalanish[tahrir | manbasini tahrirlash]


Birinchi koordinatsion sonni radial taqsimlash funksiyasi g (r) yordamida aniqlash mumkin:[16][17]
Ikkinchi koordinatsion raqam xuddi shunday aniqlanadi:
Manbalar[tahrir | manbasini tahrirlash]
- ↑ Haaland, Arne; Shorokhov, Dmitry J.; Tutukin, Andrey V.; Volden, Hans Vidar; Swang, Ole; McGrady, G. Sean; Kaltsoyannis, Nikolas; Downs, Anthony J.; Tang, Christina Y.; Turner, John F. C. (2002). „Molecular Structures of Two Metal Tetrakis(tetrahydroborates), Zr(BH4)4 and U(BH4)4: Equilibrium Conformations and Barriers to Internal Rotation of the Triply Bridging BH4 Groups“. Inorganic Chemistry. 41-jild, № 25. 6646–6655-bet. doi:10.1021/ic020357z. PMID 12470059.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ De, A.K.. A Text Book of Inorganic Chemistry. New Age International Publishers, 2003 — 88 bet. ISBN 978-8122413847.
- ↑ Hermann, Andreas; Lein, Matthias; Schwerdtfeger, Peter (2007). „The Search for the Species with the Highest Coordination Number“. Angewandte Chemie International Edition. 46-jild, № 14. 2444–7-bet. doi:10.1002/anie.200604148. PMID 17315141.
- ↑ Sinha, Ashok K. (1972). „Topologically close-packed structures of transition metal alloys“. Progress in Materials Science. 15-jild, № 2. Elsevier BV. 81–185-bet. doi:10.1016/0079-6425(72)90002-3. ISSN 0079-6425.
- ↑ Niemeyer, Mark; Power, Philip P. (1998-05-18). „Synthesis and Solid-State Structure of 2,6-Trip2C6H3Tl (Trip=2,4,6-iPr3C6H2): A Monomeric Arylthallium(I) Compound with a Singly Coordinated Thallium Atom“. Angewandte Chemie International Edition (inglizcha). 37-jild, № 9. 1277–1279-bet. doi:10.1002/(SICI)1521-3773(19980518)37:9<1277::AID-ANIE1277>3.0.CO;2-1. ISSN 1521-3773. PMID 29711226.
- ↑ Crabtree, Robert H.. The Organometallic Chemistry of the Transition Metals. John Wiley & Sons, 2009. ISBN 9780470257623.
- ↑ De Graef, Marc. Structure of Materials: An Introduction to Crystallography, Diffraction and Symmetry. Cambridge University Press, 2007 — 515 bet. ISBN 978-0-521-65151-6. 15-mart 2019-yilda qaraldi. (Wayback Machine saytida 2021-04-29 sanasida arxivlangan)
- ↑ „Closest Packed Structures“. Chemistry LibreTexts (2-oktabr 2013-yil). Qaraldi: 28-iyul 2020-yil.
- ↑ Massa, Werner. Crystal Structure Determination, English, Springer, 1999 — 67–92 bet.
- ↑ 10,0 10,1 10,2 10,3 10,4 Wells, A.F.. Structural Inorganic Chemistry, 5th, Oxford Science Publications, 1984. ISBN 978-0198553700.
- ↑ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ „II. Coordination of the atoms“. 2012-yil 13-iyunda asl nusxadan arxivlangan. Qaraldi: 2014-yil 9-noyabr.
- ↑ 13,0 13,1 Mittemeijer, Eric J.. Fundamentals of Materials Science: The Microstructure–Property Relationship using metals as model systems. Springer, 2010. ISBN 9783642105005.
- ↑ Piróth, A.. Fundamentals of the Physics of Solids: Volume 1: Structure and Dynamics. Springer, 2007 — 227 bet. ISBN 9783540726005.
- ↑ Diebold, Ulrike (2003). „The surface science of titanium dioxide“. Surface Science Reports. 48-jild, № 5–8. 53–229-bet. Bibcode:2003SurSR..48...53D. doi:10.1016/S0167-5729(02)00100-0. ISSN 0167-5729.
- ↑ Waseda, Y.. The Structure of Non-crystalline Materials: Liquids and Amorphous Solids, Advanced Book Program. McGraw-Hill International Book Company, 1980. ISBN 978-0-07-068426-3. 16-oktabr 2020-yilda qaraldi.
- ↑ Vahvaselkä, K. S.; Mangs, J. M. (1988). „X-ray diffraction study of liquid sulfur“. Physica Scripta. 38-jild, № 5. 737-bet. Bibcode:1988PhyS...38..737V. doi:10.1088/0031-8949/38/5/017.
- ↑ Toofan, Jahansooz (1994). „A Simple Expression between Critical Radius Ratio and Coordination Number“. Journal of Chemical Education. 71-jild, № 2. 147-bet. Qaraldi: 3–yanvar 2022–yil.
{{cite magazine}}: CS1 maint: date format () - ↑ „Errata“. Qaraldi: 3–yanvar 2022–yil.
{{cite magazine}}: Cite magazine requires|magazine=(yordam)CS1 maint: date format ()




