Termodinamikaning ikkinchi qonuni
Termodinamikaning ikkinchi qonuni termodinamik tizim holatining funksiyasi sifatida entropiya mavjudligini belgilaydi va mutlaq termodinamik harorat tushunchasini kiritadi, yaʼni „ikkinchi qonun entropiya qonuni“ va uning xossalari. Izolyatsiya qilingan tizimda entropiya oʻzgarmay qoladi yoki ortib boradi (muvozanatsiz jarayonlarda), termodinamik muvozanat oʻrnatilganda (entropiyani oshirish qonuni) maksimal darajaga etadi. Adabiyotlarda topilgan termodinamikaning ikkinchi qonunining turli formulalari entropiyani oshirish qonunining oʻziga xos oqibatlaridir.
Termodinamikaning ikkinchi qonuni termodinamik jismning termometrik xossasini va haroratni oʻlchash moslamasini tanlashda oʻzboshimchalikka bogʻliq boʻlmagan ratsional harorat shkalasini qurish imkonini beradi.
Birgalikda birinchi va ikkinchi qonunlar fenomenologik termodinamikaning asosini tashkil qiladi, bu ikkita printsipning rivojlangan oqibatlari tizimi sifatida qaralishi mumkin. Shu bilan birga, termodinamik tizimda birinchi qonun tomonidan ruxsat etilgan barcha jarayonlardan (yaʼni energiyaning saqlanish qonuniga zid boʻlmagan jarayonlar) ikkinchi qonun sizga haqiqatda sodir boʻlishi mumkin boʻlgan jarayonlarni tanlashga imkon beradi. termodinamika qonunlari, oʻz-oʻzidan sodir boʻladigan jarayonlarning yoʻnalishini oʻrnating, termodinamik jarayonda foydali foydalanish mumkin boʻlgan energiya qiymatining chegarasini toping. termodinamika qonunlari, shuningdek termodinamik tizimlarda muvozanat mezonlarini shakllantirish.
Tarixiy maʼlumot
[tahrir | manbasini tahrirlash]Sadi Karno bugʻ dvigatellariga bagʻishlangan „Olovning harakatlantiruvchi kuchi va bu kuchni ishlab chiqishga qodir boʻlgan mashinalar haqida fikr yuritish“ (1824) tadqiqotida birinchi boʻlib termodinamikaning ikkinchi qonuni asosidagi gʻoyani shakllantirdi. Gʻoyaga koʻra: harorat farqining yoʻqligi, issiqlikni ishga aylantirib boʻlmaydi; issiqlik dvigateli har xil haroratga ega boʻlgan kamida ikkita issiqlik rezervuariga ega boʻlishi kerak — isitgich va suvitgich.
Uilyam Tomson (Lord Kelvin) Karnotning ishiga asoslanib, mutlaq termodinamik harorat shkalasini taklif qildi (1848) va termodinamikaning ikkinchi qonunini quyidagicha ifodaladi(1851): mumkin boʻlmagan jarayon, uning yagona natijasi tizim tomonidan issiqlikni bir manbadan olish va ekvivalent hajmdagi ishlarni bajarish . Tomson printsipidan Karno teoremasi kelib chiqadi, uning asosida mutlaq termodinamik harorat shkalasini qurish mumkin.
„Termodinamikaning ikkinchi qonuni“ nomi va tarixan uning birinchi formulasi Rudolf Klauziyga (1850) tegishli: jarayon mumkin emas, uning yagona natijasi tizimning bir jismdan issiqlikni qabul qilish va uni boshqa jismga oʻtkazishdir. Issiqlik sovuqroq jismdan issiqroq jismga oʻz-oʻzidan oʻtolmaydi .
Josiah Willard Gibbs, 1876-1878 yillarda nashr etilgan. U oʻzining „Geterogen moddalarning muvozanati toʻgʻrisida“ asarida termodinamik holatda maksimal entropiya printsipi shaklida entropiya ortishi qonunini shakllantirdi. har qanday murakkablikdagi tizimlar uchun oʻz-oʻzidan sodir boʻladigan jarayonlarning yoʻnalishini va termodinamik muvozanat shartlarini aniqlashga imkon beruvchi muvozanat va olingan fundamental tenglamalar . Eʼtibor bering, yuqorida aytib oʻtilgan maksimal entropiya printsipi Gibbs tomonidan tuzilgan minimal ichki energiya printsipiga ekvivalentdir (termodinamik muvozanat holatida izolyatsiyalangan tizimning ichki energiyasi minimaldir).
Lyudvig Boltsman 1877-yilda „Issiqlikning mexanik nazariyasi ikkinchi qonuni va issiqlik muvozanati teoremalarida ehtimollar nazariyasi oʻrtasidagi bogʻliqlik toʻgʻrisida“ nomli asarida entropiya va makroholatning statistik ogʻirligi oʻrtasidagi munosabatni koʻrsatdi. Boltzmanning entropiya qonuni oddiy statistik talqinni oldi: tizim eng ehtimoliy holatga intiladi, yaʼni faqat shu jarayonlar oʻz-oʻzidan sodir boʻladi, bunda tizim kamroq ehtimollik holatidan ehtimoliyroq holatga oʻtadi. Boltsmanning entropiyani atom-molekulyar darajadagi tartibsizlik oʻlchovi sifatida talqin qilishi, agar „entropiya“ atamasini „tartibsizlik“ soʻzi bilan almashtirsak, yaqqol namoyon boʻladigan bir qancha muhim qonuniyatlarni kashf qilish imkonini berdi.
Vilgelm Ostvald 1892 yilda termodinamikaning ikkinchi qonunini 2-tur doimiy harakat mashinasini yaratishning mumkin emasligini, yaʼni bir issiqlik rezervuaridan ishlay oladigan siklik ishlaydigan izotermik issiqlik dvigatelini yaratish mumkin emasligi haqidagi bayonot tarzida shakllantirdi. Shuning uchun doimiy haroratli muhitdan olingan barcha energiyani ishga aylantirish 2-turdagi abadiy harakat mashinasini yaratishning mumkin emasligi toʻgʻridan-toʻgʻri yuqoridagi Tomson printsipidan kelib chiqib, unga ekvivalentdir.
Hermann Helmgolts (1884) birinchi boʻlib, entropiya va mutlaq termodinamik haroratni aniqlash uchun aylana jarayonlarini koʻrib chiqish va ideal gazning mavjudligi haqidagi farazni oʻz ichiga olishni hojati yoʻqligiga eʼtibor qaratdi. Helmgoltsning shogirdi N. N. Shiller 1887-1910 yillardagi asarlarida bu tezisni ishlab chiqdi va Konstantin Karateodori (1909) Helmgolts gʻoyasini adiabatik erishib boʻlmaydiganlik tamoyili orqali asosladi. Karateodor formulasida termodinamikaning ikkinchi qonuni uning har bir muvozanat holatiga yaqin uning shunday holatlari mavjudligini postulat qiladi, ularga muvozanat adiabatik jarayon orqali dastlabki holatdan erishib boʻlmaydi. Karateodoriy ishida ushbu qoidaning aniqligi yoʻqligi uni matematik oʻrganishning puxtaligi bilan qoplanadi.
1925 yilda Tatyana Afanas’eva-Ehrenfest termodinamikaning ikkinchi qonuni ikkita mustaqil qismni oʻz ichiga oladi: entropiya va mutlaq termodinamik harorat mavjudligi haqidagi bayonot va entropiyani oshirish qonuni. Afanasiev-Ehrenfest ikkinchi qonunning birinchi qismi toʻrtta aksiomaga asoslanadi va muvozanat holatlari va muvozanat jarayonlariga, ikkinchi qismi esa ikkita aksiomaga asoslanadi va muvozanat boʻlmagan jarayonlarga taalluqlidir.
1954-yilda N. I. Belokon ikkinchi qonunning turli formulalarini tanqidiy tahlil qilish asosida "Klassik termodinamikaning ikkinchi qonuni doirasida entropiyaning mavjudligi tamoyilini qurish, qaytarib boʻlmaydiganlik postulatlari notoʻgʻri va bir qator yashirin va mutlaqo boʻsh taxminlarni oʻz ichiga oladi. Belokon Afanasyeva-Erenfest g‘oyalarini rivojlantirar ekan, termodinamikaning ikkinchi qonunini ikki tamoyilga ajratdi: „termostatikaning ikkinchi qonuni“ (mutlaq termodinamik harorat va entropiyaning mavjudligi printsipi) va aslida „ikkinchi qonun“ termodinamikaning, shuningdek, Belokonning aniq simmetrik postulatiga asoslanib, qaytmaslik postulatidan mustaqil entropiyaning mavjudligi tamoyilini asoslashni taklif qildi.
Termodinamikaning ikkinchi qonunining ochilishi va shakllanishi
[tahrir | manbasini tahrirlash]"Termodinamikaning ikkinchi qonunining ochilish tarixi fanning umumiy tarixidagi eng ajoyib boblardan biri bo‘lib, uning oxirgi sahifalari hali tugallanmagan. Termodinamikaning ikkinchi qonuni deb ataydigan tabiat sirlari pardasini ko‘tarish uchun ko‘plab xalq daholarining saʼy-harakatlari zarur edi. Termodinamikaning ikkinchi qonuni issiqlik dvigatellarining ish nazariyasi sifatida vujudga kelib, u issiqlikning ishga aylanishi maksimal samaraga erishish shartlarini belgilaydi. Birinchi marta fransuz muhandisi Sadi Karno tomonidan amalga oshirilgan issiqlik dvigatellari ishlashining nazariy tadqiqotlari shuni koʻrsatdiki, issiqlik dvigatellarining texnik jihatdan mukammal emasligi bilan bogʻliq emas. issiqlikning energiya uzatish usuli sifatida xususiyati, bu uning qiymatiga cheklovlar qoʻyadi. Karno issiqlik dvigatellarining samaradorligi termodinamik tsiklga va ishchi suyuqlikning tabiatiga bogʻliq emas, balki butunlay tashqi manbalar — isitgich va muzlatgichning haroratiga bogʻliq degan xulosaga keldi.
Karnoning ishi issiqlik va ishning ekvivalentligi printsipi kashf etilishidan va energiyaning saqlanish qonunining umumjahon tan olinishidan oldin yozilgan. Karno oʻz xulosalarini ikkita qarama-qarshi asos bilan asosladi: tez orada rad etilgan kalorifik nazariya va gidravlik analogiya. Biroz vaqt oʻtgach, R.Klauzius va V.Tomson Karno teoremasini energiyaning saqlanish qonuni yordamida, klassik termodinamikaning ikkinchi qonuni maʼnosiga asos soldilar.
Termodinamikaning ikkinchi qonuni-xuddi birinchisi kabi, umuminsoniy tajribani umumlashtirishdir. Tajriba shuni koʻrsatadiki, taʼrifi boʻyicha energiya uzatish shakllari boʻlgan issiqlik va ish ekvivalent emas. Ish bajarsa toʻgʻridan-toʻgʻri issiqlikka aylanishi mumkin, masalan, ishqalanish orqali va bu holda bir jismning holati oʻzgaradi, issiqlik miqdori bu xususiyatga ega emas. Issiqlik taʼminoti faqat tizimning ichki energiyasini oshirishga olib keladi. Berilgan issiqlik miqdori natijasida hosil boʻlgan termodinamik ishni faqat yuqoridagi parametrlarni oʻzgartirish orqali bilvosita olish mumkin. Bunda issiqlik manbaining o‘zini sovutishdan tashqari, ochiq jarayonda bir jismning termodinamik holatining o‘zgarsa, yopiq jarayonda esa bir necha jismning termodinamik holati o‘zgaradi. ishchi organ olingan issiqlikning bir qismini oʻtkazishi kerak. Issiqlik dvigatelida issiqlikni qabul qiluvchi sovutgich hisoblanadi. Issiqlikning bir qismini boshqa jismlarga oʻtkazish jarayoni kompensatsiya deyiladi. Tajriba shuni koʻrsatadiki, issiqlikni kompensatsiyasiz ishga aylantirish mumkin emas, issiqlik dvigatellarida ish ishlaydigan suyuqlikni kengaytirish orqali amalga oshiriladi. Mashinaning uzluksiz ishlashi uchun ishchi suyuqlikni asl holatiga qaytarish kerak. Shu maqsadda, u ish sarflash orqali siqilgan boʻlishi kerak. Agar siqish kengayish bilan bir xil haroratda amalga oshirilsa, unda kengayish paytida olingan barcha ishlarni sarflash kerak boʻladi va bu dvigatelning samaradorligi nolga teng boʻladi. Siqish ishi kengayish ishidan kamroq boʻlishi uchun pastroq haroratda siqish kerak. Ishlaydigan suyuqlikning haroratini pasaytirish uchun issiqlikning bir qismi uchinchi tanaga — muzlatgichga oʻtkazilishi kerak. Issiqlik dvigatelining samaradorligi, taʼrifiga koʻra, bir tsiklda ijobiy ishga aylantirilgan issiqlik miqdori ishchi suyuqlikka berilgan issiqlikning umumiy miqdoriga nisbatiga tengdir.Bu yerda — isitgich bergan issiqlik miqdori, — muzlatgich olgan issiqlik miqdori, — termodinamik ish.
Termodinamikada issiqlik dvigatellari, sovutish mashinalari va issiqlik nasoslarini oʻz ichiga olgan issiqlik dvigatellari uzluksiz ishlashini taʼminlash uchun issiqlik dvigatelining ishchi suyuqligi vaqti-vaqti bilan asl holatiga qaytadigan siklda ishlashi kerak. Issiqlik dvigatellarining samaradorligini oshirish uchun ideallashtirilgan issiqlik dvigatellari sikllaridan biri Sadi Karno tomonidan taklif qilingan sikldir.
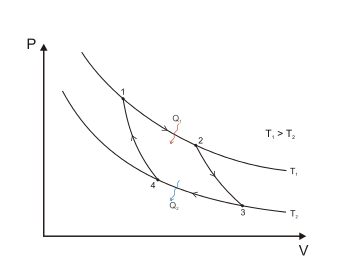
1-diagrammada doimiy haroratli ikkita issiqlik manbalari oʻrtasida amalga oshiriladigan teskari Karno sikli koʻrsatilgan. U ikkita izotermik (1-2 va 3-4) va ikkita adiabatik (2-3 va 4-1) jarayonlardan iborat. Ushbu issiqlik dvigatelining ishchi suyuqligi ideal gazdir.
Karno teoremasi natijasi: teskari Karno siklining issiqlik samaradorligi ishchi modda tabiatiga bogʻliq emas va faqat isitgich harorati va muzlatgich harorati bilan belgilanadi:Failed to parse (sintaktik xato): {\displaystyle \eta =\frac{T_1-T_2}{T_1}=1 — \frac{T_2}{T_1} }
Termodinamikaning ikkinchi qonunining umumiy matematik ifodasi.
[tahrir | manbasini tahrirlash]Klassik termodinamikaning ikkinchi qonuni izolyatsiyalangan tizimlarning mavjudligi va entropiyasining ortishining yagona printsipiga asosan tuzilgan. Tenglama va tengsizlikdan:
Entropiyaning statistik taʼrifi
[tahrir | manbasini tahrirlash]Statistik fizikada entropiya termodinamik sistema ehtimollik funksiyasi sifatida qaraladi :Bu yerda ─ Boltsman doimiysi, ─ termodinamik holat ehtimoli; makroholatni amalga oshiradigan mikroholatlar soni bilan belgilanadi.
Entropiyaning fizik maʼnosi
[tahrir | manbasini tahrirlash]Termodinamik tizimning holatini belgilovchi kattaliklar orasida entropiya alohida oʻrinni egallaydi. Klauzius tomonidan berilgan entropiyaning matematik talqiniga asoslanib, har qanday cheksiz kichik kvazistatik jarayonning issiqligi entropiya differensiali va termodinamik haroratning mahsulotiga teng. Boshqacha qilib aytadigan boʻlsak, entropiya har qanday cheksiz kvazistatik jarayon uchun, shuningdek, har qanday chekli kvazstatik izotermik jarayon uchun kamaytirilgan issiqlik oʻlchovidir.
Entropiya jismoniy miqdor sifatida oʻzining mavhumligi bilan ajralib turadi, entropiyaning fizik maʼnosi bevosita uning matematik ifodasidan kelib chiqmaydi va oddiy intuitiv idrok etishga mos kelmaydi. Shu munosabat orqali entropiyaning jismoniy maʼnosini tushunishga bir necha bor urinishlar qilingan. Urinishlar koʻproq tushunarli tushunchalar bilan entropiya oʻxshashligini izlashga asoslangan edi. Shubhasiz, bu turdagi analogiyalar sunʼiydir va ularning entropiyani talqin qilish uchun foydaliligi juda shubhali. Bundan tashqari, entropiya va issiqlik sigʻimi oʻrtasidagi oʻxshashlikni chizishga urinish ham mumkin emas. Keling, tananing oʻziga xos entropiyasining ifodasini taqqoslaylik:
oʻziga xos issiqlik sigʻimi ifodasi bilan:
.
Bu ifodalarning oʻxshashligi issiqlik sigʻimi va entropiyaning bir xil kattaliklari va bir xil oʻlchamlaridan foydalanishdadir. Ikkala miqdor ham birlik massa va birlik haroratga toʻgʻri keladigan issiqlik miqdorini ifodalaydi. Biroq, agar harorat issiqlik sigʻimi formulasiga differentsial shaklda kiritilgan boʻlsa va uni har qanday harorat shkalasida oʻlchash mumkin boʻlsa, u holda absolut harorat () entropiya formulasida paydo boʻladi. Issiqlik sigʻimi va entropiya oʻrtasidagi farq shundaki, solishtirma issiqlik sigʻimi 1 kg moddani bir gradus Selsiy (yoki Kelvin) ga qizdirish uchun zarur boʻlgan issiqlik miqdoridir. Entropiya — massa birligiga va absolut harorat birligiga toʻgʻri keladigan issiqlik miqdori . Qaysidir maʼnoda, bu oʻziga xos energiya. Entropiya ham holat funksiyasidir, lekin uning qiymati tizimning berilgan holat yaqinidagi o‘zgarishiga bog‘liq emas va u statik miqdordir.
Fizika nuqtai nazaridan, entropiya haqiqiy termodinamik jarayonning qaytarilmasligi, ideal emasligi darajasini tavsiflaydi. Bu energiyaning tarqalishi oʻlchovi, shuningdek issiqlikni ishga aylantirish uchun foydalanishga yaroqliligi nuqtai nazaridan energiyani baholash oʻlchovidir.
- Termodinamikaning ikkinchi qonuni:
.
Xulosa I. Issiqlikni toʻliq ishga aylantirib boʻlmaydi:Xulosa II. Har qanday qaytarilmas issiqlik dvigatelining tashqi manbalarning berilgan haroratida samaradorligi yoki sovutish quvvati har doim bir xil manbalar oʻrtasida ishlaydigan reversiv mashinalarning samaradorligi yoki sovutish quvvatidan past boʻladi.
Termodinamikaning ikkinchi qonunini qoʻllash chegaralari
[tahrir | manbasini tahrirlash]Klauzius va uning izdoshlarining g‘oyalar tizimida entropiyaning mavjudligi va ortishining ikkala tamoyili ham qaytarilmaslik postulatiga (Klauzius, Tomson-Kelvin, Plank va boshqalar postulatlari) asoslanadi. Entropiyaning o‘sishi tamoyili esa, energiyaning saqlanish qonuni bilan yonma-yon turgan tabiatning umuminsoniy qonuni darajasiga koʻtarilgan. Shunday qilib, ushbu asosiy qonunning har qanday buzilishi uning barcha oqibatlarining qulashiga olib keladi, bu esa termodinamikaning taʼsir doirasini sezilarli darajada cheklaydi.
= "Koinotning issiqlik oʻlimi" gipotezasi
[tahrir | manbasini tahrirlash]Termodinamikaning ikkinchi qonuni va evolyutsionizmning tanqidi
[tahrir | manbasini tahrirlash]Termodinamikaning ikkinchi qonuni baʼzan evolyutsiya nazariyasi tanqidchilari tomonidan tabiatning murakkablik yoʻnalishi boʻyicha rivojlanishi mumkin emasligini koʻrsatish uchun ishlatiladi. Biroq, fizik qonunning bunday qoʻllanilishi notoʻgʻri, chunki entropiya faqat yopiq tizimlarda kamaymaydi, tirik organizmlar va butun Yer sayyorasi ochiq tizimlardir.
Hayot jarayonida tirik organizmlar bir turdagi energiyani boshqa turdagi energiyaga aylantiradi va shu bilan koinot entropiyasining umumiy oʻsishini tezlashtiradi. Entropiyaning „tartibli“ jarayonlar orqali „mahalliy“ pasayishiga qaramay, koinot entropiyasida umumiy oʻsish kuzatiladi va tirik organizmlar bu jarayonning qaysidir maʼnoda katalizatori hisoblanadi. Shunday qilib, termodinamikaning ikkinchi qonunining bajarilishi kuzatiladi, tirik organizmlarning paydo boʻlishi va mavjudligida hech qanday paradoks yoʻq.
Sm. Shuningdek
[tahrir | manbasini tahrirlash]Adabiyot
[tahrir | manbasini tahrirlash]- Ehrenfest-Afanassjewa T. Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (nem.) // Zeitschrift für Physik. — 1925. — Vol. 33, Nr. 1. — P. 933-945.
- Ehrenfest-Afanassjewa T. Berichtigung zu der Arbeit: Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (nem.) // Zeitschrift für Physik. — 1925. — Vol. 34, Nr. 1. — P. 638.
- Die Grundlagen der Thermodynamik.
- Helmholtz Hermann von. Studien zur Statik monocyklischer Systeme (nem.) // Sitzungsberichte der Königlich Preussischen Akademie der Wissenschaften zu Berlin. — 1884. — Nr. 1. Halbband. — P. 159—177.
- Afanaseva-Erenfest T. A. Neobratimost, odnostoronnost i vtoroe nachalo termodinamiki (rus.) // Jurnal prikladnoy fiziki. — 1928. — T. 5, № 3—4. — S. 3—30.
- Termodinamika.
- Termodinamikaning asosiy tamoyillari.
- Buyuk Sovet Entsiklopediyasi. Arxivnaya kopiya ot 6 sentyabrya 2018 na Wayback Machine
- Buyuk rus entsiklopediyasi.
- Техническая термодинамика.
- Termodinamikaning ikkinchi qonuni: Sadi Karno — V. Tomson-Kelvin — R. Klauzius — L. Boltsman — M. Smoluchovskiy.
- Termodinamika va statistik fizikaning tarixi va metodologiyasi.
- Fizik kimyo kursi.
- Termodinamika. Statistik mexanika..
- Об основаниях термодинамики.
- Karateodori K. Ob osnovax termodinamiki // Razvitie sovremennoy fiziki / Otv. red. B. G. Kuznesov. — M.: Nauka, 1964. — S. 3—22.
- Umumiy fiziki kursi.
- Fizika. Katta ensiklopedik lugʻat.
- Kimyoviy ensiklopediya.
- Развитие и приложение понятия энтропии.

















