Siglec
Siglecs (sial kislotasi bilan bogʻlaydigan immunoglobulin tipidagi lektinlar) sialik kislotani bogʻlaydigan hujayra yuzasi oqsillari. Ular asosan immun hujayralari yuzasida joylashgan boʻlib, I tipidagi lektinlarning bir qismidir. Hujayra yuzasi retseptorlari va ligandlarning oʻzaro taʼsiriga asoslangan turli funktsiyalarni taʼminlaydigan 14 xil sutemizuvchi Siglecs mavjud[1].
Tarixi[tahrir | manbasini tahrirlash]
Siglecning birinchi taʼriflangan nomzodi Sialoadhesin (Siglec-1/CD169) makrofaglarda lektinga oʻxshash adezyon oqsili edi[2]. Ajit Varki va uning hamkasblari tomonidan ilgari klonlangan CD22 (yopishqoqlik va faollashuvda ishtirok etuvchi B hujayra yuzasi oqsili) ustida olib borilgan parallel tadqiqotlar sialik kislotani aniqlashning bevosita dalillarini koʻrsatdi. Kroker tomonidan sialoadhesinning keyingi klonlanishi CD22 (Siglec-2), CD33 (Siglec-3) va miyelin bilan bogʻlangan glikoprotein (MAG/Siglec-4) ga oʻxshashligini aniqladi va bu „Sialoadhesins“ oilasini yaratish taklifiga olib keldi. Keyin Varki Siglec atamasini yaxshiroq alternativa va I-turi (Ig-tipi) lektinlarning kichik toʻplami sifatida taklif qildi. Ushbu nomenklatura ushbu molekulalar ustida ishlaydigan deyarli barcha tadqiqotchilar tomonidan kelishilgan va qabul qilingan (odatga koʻra, Siglec har doim katta harf bilan yoziladi).) Odamlarda tuzilishi jihatidan CD33 ga juda oʻxshash bir nechta qoʻshimcha Siglecslar (Siglecs 5-12) aniqlangan va shuning uchun ular birgalikda „CD33 bilan bogʻliq Siglecslar“ deb ataladi[3]. Siglec-14 va Siglec-15 kabi boshqa Sigleklar aniqlandi. Siglekslar ikkita alohida guruhga boʻlingan: birinchi va yuqori darajada saqlanib qolgan sut emizuvchilar guruhi Sialoadhesins, CD22, MAG va Siglec-15 dan tashkil topgan va ikkinchi guruh CD33 bilan chambarchas bogʻliq boʻlgan Siglecslardan iborat[4]. Siglec-8 va Siglec-9 kabi boshqalar sichqon va kalamushlarda homologlarga ega (har ikkalasida mos ravishda Siglec-F va Siglec-E). Odamlarda sichqonlarga qaraganda koʻproq Sigleclar mavjud va shuning uchun raqamlash tizimi inson oqsillariga asoslangan[5].
Tuzilishi[tahrir | manbasini tahrirlash]

Siglecs I-toifa transmembran oqsillari boʻlib, NH — terminali hujayradan tashqari boʻshliqda va COO terminali sitozolikdir[6]. Har bir Siglec N-terminal V tipidagi immunoglobulin domenini (Ig domeni) oʻz ichiga oladi, u sial kislotasi uchun bogʻlovchi retseptor sifatida ishlaydi. Bu lektinlar I-tipli lektinlar guruhiga joylashtirilgan, chunki lektin sohasi immunoglobulin burmasidir. Barcha Siglecslar hujayra yuzasidan C2 tipidagi Ig domenlari orqali chiqariladi, ular hech qanday bogʻlanish faolligiga ega. Siglecslar bu C2 tipidagi domenlar sonida farqlanadi[5]. Ushbu oqsillar Ig domenlarini oʻz ichiga olganligi sababli, ular immunoglobulinlar superoilasi (IgSF) aʼzolaridir.
CD22 va CD33 bilan bogʻliq oila kabi koʻpchilik Siglecs, ularning sitozolik mintaqasida ITIMlarni (immunoreseptor tirozinga asoslangan inhibitiv motivlar) oʻz ichiga oladi[6]. Ular fosforillanishni oʻz ichiga olgan signalizatsiya yoʻllarini, masalan, ITAMlar (immunoreseptorlar tirozinga asoslangan faollashtirish motivlari) tomonidan qoʻzgʻatilganlarni tartibga solish uchun harakat qiladi[7]. Biroq, baʼzilari, Siglec-14 kabi, DAP12 kabi ITAM oʻz ichiga olgan adapter oqsillarini biriktirishga yordam beradigan musbat aminokislota qoldiqlarini oʻz ichiga oladi[1].
Ligand bogʻlanishi[tahrir | manbasini tahrirlash]
Sial kislotaning kislotali tabiati tufayli Siglec faol joylari fiziologik pH da musbat zaryadlangan konservalangan arginin qoldigʻini oʻz ichiga oladi. Ushbu aminokislota shakar qoldigʻining karboksil guruhi bilan tuz koʻpriklarini hosil qiladi[5]. Bu eng yaxshi Sialoadhesinda koʻrinadi, u yerda 97-pozitsiyadagi arginin sialik kislotaning COO - guruhi bilan tuz koʻprigi hosil qiladi va barqaror oʻzaro taʼsirni keltirib chiqaradi[8]. Har bir lektin domeni sialik kislotani glikan bilan bogʻlaydigan bogʻlanish uchun xosdir. Sialik kislota glikozid birikmalarining shakllanishida ishtirok etishi mumkin boʻlgan koʻplab gidroksil guruhlarini oʻz ichiga oladi. Aksariyat sialik kislotalar a anomerik konfiguratsiyada 2, 3, 6 va baʼzan 8 gidroksil guruhlari (ular biriktirilgan uglerodga bogʻliq son) orqali bogʻlanadi. Har bir Siglecning oʻziga xosligi shakar ligandlari va Siglec aminokislotalari oʻrtasidagi turli xil kimyoviy oʻzaro taʼsirlarga bogʻliq. Shakar va oqsil aminokislotalarida alohida guruhlarning kosmosdagi holati har bir Siglec bogʻlaydigan sialik kislota aloqasiga taʼsir qiladi. Masalan, Sialoadhesin a2,6 bogʻlanishlarga nisbatan a2,3 bogʻlanishlarni afzal koʻradi[8].
Funksiyasi[tahrir | manbasini tahrirlash]
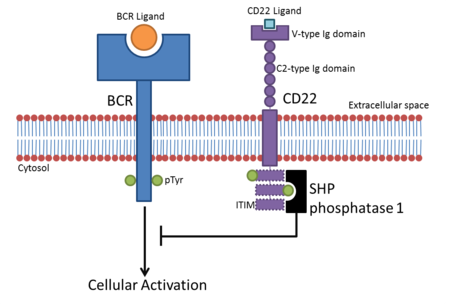
Siglecsning asosiy vazifasi sialik kislotalarni oʻz ichiga olgan glikanlarni bogʻlashdir. Ushbu retseptor-glikan oʻzaro taʼsirlari hujayra yopishishida, hujayra signalizatsiyasida va boshqalarda qoʻllanilishi mumkin. Siglecs funktsiyasi ularning hujayra taqsimoti bilan cheklangan. Masalan, MAG faqat oligodendrositlar va shvann hujayralarida topilgan, Sialoadhesin esa makrofaglarda lokalizatsiya qilingan.
Siglcklarning koʻpchiligi qisqa va hujayra yuzasidan uzoqqa choʻzilmaydi. Bu koʻpchilik Siglecslarning boshqa hujayralar bilan bogʻlanishiga toʻsqinlik qiladi, chunki sutemizuvchilar hujayralari sial kislotasi oʻz ichiga olgan glikanlar bilan qoplangan. Bu shuni anglatadiki, koʻpchilik Siglecs faqat bitta hujayra yuzasida ligandlarni bogʻlaydi, cis -ligandlar deb ataladi, chunki ular bir hujayradagi glikanlar bilan „botqoqlanadi“. Istisnolardan biri sialoadhesin boʻlib, u 16 ta C2-Ig domenini oʻz ichiga oladi, bu trans -ligandlarni, yaʼni boshqa hujayralardagi ligandlarni bogʻlash imkonini beruvchi uzoq, kengaytirilgan oqsil ishlab chiqaradi. Boshqalar, masalan, MAG ham trans -ligandlarni bogʻlashi koʻrsatilgan.
Manbalar[tahrir | manbasini tahrirlash]
- ↑ 1,0 1,1 „Siglecs and immune regulation“. Annual Review of Immunology. 30-jild. 2012. 357–92-bet. doi:10.1146/annurev-immunol-020711-075018. PMC 3781015. PMID 22224769.
- ↑ „Properties and distribution of a lectin-like hemagglutinin differentially expressed by murine stromal tissue macrophages“. The Journal of Experimental Medicine. 164-jild, № 6. December 1986. 1862–75-bet. doi:10.1084/jem.164.6.1862. PMC 2188478. PMID 3783087.
- ↑ „Siglecs in the immune system“. Immunology. 103-jild, № 2. June 2001. 137–45-bet. doi:10.1046/j.0019-2805.2001.01241.x. PMC 1783234. PMID 11412300.
- ↑ „Siglec-mediated regulation of immune cell function in disease“. Nature Reviews. Immunology. 14-jild, № 10. October 2014. 653–66-bet. doi:10.1038/nri3737. PMC 4191907. PMID 25234143.
- ↑ 5,0 5,1 5,2 „Siglecs--the major subfamily of I-type lectins“. Glycobiology. 16-jild, № 1. January 2006. 1R–27R-bet. doi:10.1093/glycob/cwj008. PMID 16014749.
- ↑ 6,0 6,1 „Siglecs and their roles in the immune system“. Nature Reviews. Immunology. 7-jild, № 4. April 2007. 255–66-bet. doi:10.1038/nri2056. PMID 17380156.
- ↑ „Immunoreceptor tyrosine-based inhibition motifs: a quest in the past and future“. Immunological Reviews. 224-jild. August 2008. 11–43-bet. doi:10.1111/j.1600-065X.2008.00666.x. PMID 18759918.
- ↑ 8,0 8,1 „Characterization of human sialoadhesin, a sialic acid binding receptor expressed by resident and inflammatory macrophage populations“. Blood. 97-jild, № 1. January 2001. 288–96-bet. doi:10.1182/blood.V97.1.288. PMID 11133773.
Bu maqola birorta turkumga qoʻshilmagan. Iltimos, maqolaga aloqador turkumlar qoʻshib yordam qiling. (Aprel 2024) |
