Fotooksigenatsiya
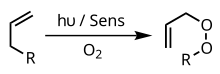
Fotooksigenatsiya - yorug'lik ta'sirida oksidlanish reaksiyasi bo'lib, unda molekulyar kislorod mahsulot(lar)ga kiritiladi.[1][2] Fotooksigenatsiya reaksiyalariga bo'lgan dastlabki tadqiqot qiziqishi 1900-yilda Oskar Raabning yorug'lik, kislorod va fotosensibilizatorlarning kombinatsiyasi hujayralar uchun juda zaharli ekanligi haqidagi kuzatishlaridan kelib chiqqan.[3] Fotooksigenatsiyaning dastlabki tadqiqotlari DNK va aminokislotalarning oksidlovchi shikastlanishiga qaratilgan edi[2], ammo yaqinda o'tkazilgan tadqiqotlar fotooksigenatsiyani organik sintez va fotodinamik terapiyada qo'llashga olib keldi.[4]
Fotooksigenatsiya reaksiyalari fotosensibilizator tomonidan boshlanadi, bu molekula ma'lum bir to'lqin uzunligidagi yorug'lik (masalan, bo'yoqlar va pigmentlar) ta'sirida qo'zg'aluvchan holatga kiradi. Keyin qo'zg'algan sensibilizator substrat yoki asosiy holatdagi molekulyar kislorod bilan reaksiyaga kirishadi va natijada kislorodli molekulaga olib keladigan energiya almashinuvi kaskadini boshlaydi. Shunday qilib, fotooksigenatsiya reaksiyalari ushbu oraliq mahsulotlarning turi va tartibi bo'yicha toifalarga bo'linadi (I-toifa, II-turdagi yoki III-turdagi[5] reaksiyalar).[2][3]
Terminologiya[tahrir | manbasini tahrirlash]
Fotooksigenatsiya reaksiyalari o'xshash nomlarga ega bo'lgan bir qator jarayonlar (ya'ni, fotosensibilizatsiyalangan oksidlanish) bilan osongina aralashtiriladi. Aniq farqlar uchta xususiyatga asoslangan holda amalga oshirilishi mumkin: oksidlanish, yorug'likning ishtiroki va molekulyar kislorodning mahsulotlarga qo'shilishi:

Sensibilizatorlar[tahrir | manbasini tahrirlash]

Sensibilizatorlar ("Sens" deb nomlanadi) flüoresan bo'yoqlari, metilen ko'k va polisiklik aromatik uglevodorodlar kabi birikmalar bo'lib, ular elektromagnit nurlanishni (odatda spektrning ko'rinadigan diapazonida) o'zlashtira oladi va oxir-oqibat bu energiyani molekulyar kislorodga yoki kislorodga o'tkazadi. fotooksigenatsiya jarayonining substrati. Tabiiy va sintetik bo'lgan ko'plab sensibilizatorlar yorug'likni ko'rinadigan spektrda singdirish uchun keng aromatik tizimlarga tayanadi.[4] Sensibilizatorlar yorug'lik ta'sirida qo'zg'atilganda, ular singl holatiga etadi, 1Sens*. Keyinchalik bu singlet tizimlararo kesishuv orqali uchlik holatiga (bu barqarorroq), 3Sens* ga aylanadi. 3Sens* - bu fotooksigenatsiya reaksiyalarining uchta turida substrat yoki 3O2 bilan reaksiyaga kirishadigan narsa.[6]
- <math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><mtext> </mtext><mrow class="MJX-TeXAtom-REL"><mover><mo> </mo><mpadded lspace="0.278em" voffset=".15em" width="+0.611em"><mi> </mi><mi> </mi></mpadded></mover></mrow><mrow class="MJX-TeXAtom-ORD"><mmultiscripts><mtext> </mtext><mo> </mo><mn> </mn></mmultiscripts></mrow><mo stretchy="false"> </mo><mrow class="MJX-TeXAtom-ORD"><mmultiscripts><mtext> </mtext><mo> </mo><mn> </mn></mmultiscripts></mrow></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img>
Molekulyar kislorod holatlari[tahrir | manbasini tahrirlash]

Klassik Lyuis tuzilmalarida molekulyar kislorod O2 ikkita kislorod atomi o'rtasida qo'sh bog'lanish sifatida tasvirlangan. Biroq, O2 ning molekulyar orbitallari aslida Lyuis tuzilmalari taklif qilgandan ko'ra murakkabroqdir. O2 ning eng yuqori egallagan molekulyar orbitali (HOMO) bir juft degeneratsiyaga uchragan antibog'lanish orbitallari, 2px * va 2py * bo'lib, ularning ikkalasi ham spinli juftlashtirilmagan elektronlar bilan birma-bir band bo'ladi.[4] Bu elektronlar O2 ning asosiy holatda (3O2 sifatida ko'rsatilgan) triplet diradikal bo'lishiga sabab bo'ladi.
Ko'pgina barqaror molekulalarning HOMO'lari molekulyar orbitallarni bog'lashdan iborat bo'lsa va shuning uchun birinchi qo'zg'atilgan holatga erishish uchun bog'lanishdan antibog'lanishga o'rtacha energiya sakrashini talab qilsa-da, molekulyar kislorodning HOMO ning antibog'lanish tabiati uning asosiy holati va birinchi qo'zg'atilgan holati o'rtasidagi energiya bo'shlig'ini kamaytirishga imkon beradi.. Bu O2 qo'zg'alishini kamroq energiya cheklovchi jarayonga aylantiradi. O2 ning birinchi qoʻzgʻaluvchan holatida asosiy holatdan 22 kkal/mol energiya ortadi, antibogʻlovchi orbitallardagi har ikkala elektron degeneratsiyalangan * orbitalni egallaydi va kislorod endi yagona holatda (1O2 sifatida koʻrsatilgan).[3] 1O2 juda reaktiv bo'lib, umri 10-100 s.[4]
Fotooksigenatsiya turlari[tahrir | manbasini tahrirlash]
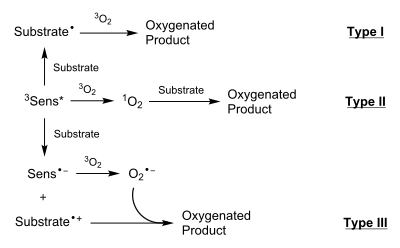
Fotooksigenatsiya reaksiyalarining uchta turi o'zlarining mexanizmlari bilan ajralib turadi, chunki ular atrof-muhit sharoitlariga qarab turli xil yoki o'xshash mahsulotlarni berishga qodir. I va II-turdagi reaksiyalar neytral oraliq moddalar orqali, III turdagi reaksiyalar esa zaryadlangan turlar orqali boradi. 1O2 ning yo'qligi yoki mavjudligi mos ravishda I va II-turdagi reaksiyalarni ajratib turadi.[1]
I-turi[tahrir | manbasini tahrirlash]
I-turdagi reaksiyalarda fotoaktivlangan 3Sens* substrat bilan oʻzaro taʼsirlanib, radikal substrat hosil qiladi, odatda substratdagi vodorod bogʻining gomolitik bogʻlanishini buzish orqali. Keyinchalik bu substrat radikali 3O2 (asosiy holat) bilan o'zaro ta'sirlanib, substrat-O2 radikalini hosil qiladi. Bunday radikal odatda boshqa substrat molekulasidan yoki erituvchidan vodorodni olish yo'li bilan so'ndiriladi. Bu jarayon reaksiyaning zanjirli tarqalishiga imkon beradi.
Misol: diradikal oraliq moddalarning kislorodni ushlab turishi[tahrir | manbasini tahrirlash]
I-turdagi fotooksigenatsiya reaksiyalari diradikal turlarni shakllantirish va ushlab turish jarayonida tez-tez qo'llaniladi. Mirbach va boshqalar. azo birikmasi diradikal uglevodorodni hosil qilish uchun fotoliz orqali parchalanadi va keyin molekulyar kislorod tomonidan bosqichma-bosqich tutiladi:[7]

II-tur[tahrir | manbasini tahrirlash]
II-turdagi reaksiyalarda 3Sens* o'z energiyasini 1O2 hosil qilish uchun nurlanishsiz o'tish orqali to'g'ridan-to'g'ri 3O2 bilan uzatadi. Keyin 1O2 substratga turli yo'llar bilan qo'shiladi, jumladan: siklik yuklanishlar (ko'pincha [4+2]), 1,2-dioksetanlarni hosil qilish uchun qo'sh bog'lanishlarga qo'shilish va olefinlar bilan ene reaksiyalari.[2]
Misol: prostaglandin sintezining kashshofi[tahrir | manbasini tahrirlash]
Sis -2-siklopenten-1,4-diol hosil qilish uchun singlet kislorodning siklopentadienga [4+2] siklo yuklanishi prostaglandinlar sintezida ishtirok etadigan keng tarqalgan bosqichdir.[8] Singlet kislorodning dastlabki qo'shilishi kelishilgan [4+2] sikl yuklanishi orqali beqaror endoperoksid hosil qiladi. Peroksidning keyingi qisqarishi ikki alkogol guruhini hosil qiladi.

III-tur[tahrir | manbasini tahrirlash]
III-turdagi reaksiyalarda 3Sens* va substrat oʻrtasida sodir boʻladigan elektron almashinuvi mavjud boʻlib, natijada anion Sens va katyonik substrat hosil boʻladi. Anion Sens elektronni 3O2 ga o'tkazib, superoksid anioni O<sub id="mwpQ">2</sub> <sup id="mwpg">-</sup> hosil bo'lgan joyda yana bir elektron o'tkazish sodir bo'ladi. Bu uzatish Sensni asosiy holatiga qaytaradi. Keyin superoksid anioni va katyonik substrat kislorodli mahsulot hosil qilish uchun o'zaro ta'sir qiladi.
Misol: indolizin fotooksigenatsiyasi[tahrir | manbasini tahrirlash]
Indolizinlarning (indolning geterotsiklik aromatik hosilalari) fotooksigenatsiyasi ham mexanik, ham sintetik kontekstda o'rganilgan. I yoki II-turdagi fotooksigenatsiya mexanizmidan o'tish o'rniga, ba'zi tadqiqotchilar 9,10-disiyanoantraken (DCA) dan fotosensitator sifatida foydalanishni tanladilar, bu esa indolizin hosilasining superoksid anion radikali bilan reaksiyasiga olib keldi. E'tibor bering, reaksiya ajratilmagan (va shuning uchun tasvirlanmagan) indolizin radikal kation oraliq mahsuloti orqali boradi:[9]

Ilovalar[tahrir | manbasini tahrirlash]
Organik sintez[tahrir | manbasini tahrirlash]
Fotooksigenatsiyaning barcha 3 turi organik sintez sharoitida qo'llanilgan. Xususan, II-turdagi fotooksigenatsiyalar eng koʻp qoʻllanilgani isbotlangan (singl kislorod hosil qilish uchun kam energiya talab qilinganligi sababli) va “organik birikmalarni fotokimyoviy oksifunksionalizatsiya qilishning eng kuchli usullaridan biri” sifatida tavsiflangan.[10] Bu reaksiyalar barcha umumiy erituvchilarda va sensibilizatorlarning keng doirasi bilan borishi mumkin.
Organik sintezda II-turdagi fotooksigenatsiyalarning ko'p qo'llanilishi Valdemar Adamning asiklik alkenlar bilan singl kislorodning ene-reaksiyasiga oid tadqiqotlaridan kelib chiqadi.[10] Sis effekti va tegishli boshqaruv guruhlari mavjudligi tufayli reaksiya hatto yuqori regioselektiv va diasteroselektivlikni ikkita qimmatli stereokimyoviy nazorat.[11] ta'minlashi mumkin -

Fotodinamik terapiya[tahrir | manbasini tahrirlash]
Fotodinamik terapiya (PDT) saraton to'qimasini yo'q qilish uchun fotooksigenatsiyadan foydalanadi.[12] O'simta ichiga fotosensibilizator yuboriladi, so'ngra Sensni qo'zg'atish uchun to'qimalarga o'ziga xos to'lqin uzunlikdagi yorug'lik ta'sir qiladi. Qo'zg'atilgan Sens odatda hujayralarga oksidlovchi zarar etkazish uchun I yoki II turdagi fotooksigenatsiya mexanizmiga amal qiladi. O'simta hujayralariga keng oksidlovchi shikastlanish o'simta hujayralarini o'ldiradi. Shuningdek, yaqin atrofdagi qon tomirlarining oksidlovchi shikastlanishi mahalliy aglomeratsiyaga olib keladi va o'simtaning ozuqaviy ta'minotini to'xtatadi va shu bilan o'simta och qoladi.[13]
PDTda ishlatiladigan Sensni tanlashda muhim e'tibor - bu Sens qo'zg'atilgan holatga erishish uchun yutadigan yorug'likning o'ziga xos to'lqin uzunligi. Chunki to'qimalarning maksimal kirib borishi 800 nm,to'lqin uzunligi atrofida erishiladi bu diapazon atrofida so'riladigan Sensni tanlash foydalidir, chunki bu PDTning dermisning eng tashqi qatlami ostidagi o'smalarga ta'sir qilishiga imkon beradi. 800 nm oynasi yorug'lik to'qimalarga kirib borishda eng samarali hisoblanadi, chunki to'lqin uzunligi 800. nm dan qisqaroq yorug'lik hujayralarning makromolekulalari tomonidan va 800. nm dan ortiq to'lqin uzunliklarida tarqala boshlaydi suv molekulalari yorug'likni o'zlashtira boshlaydi va uni issiqlikka aylantiradi.[4]
Manbalar[tahrir | manbasini tahrirlash]
- ↑ 1,0 1,1 IUPAC. Compendium of Chemical Terminology A. D. McNaught and A. Wilkinson: . Blackwell Scientific Publications, Oxford, 1997. DOI:10.1351/goldbook. ISBN 978-0-9678550-9-7. Manba xatosi: Invalid
<ref>tag; name "IUPAC-1997" defined multiple times with different content - ↑ 2,0 2,1 2,2 2,3 M. R. Iesce; et al. (2005). „Photooxygenation of Heterocycles“. Curr. Org. Chem. 9-jild, № 2. 109–139-bet. doi:10.2174/1385272053369222. Manba xatosi: Invalid
<ref>tag; name "iesce-2005" defined multiple times with different content - ↑ 3,0 3,1 3,2 C.S. Foote (1968). „Mechanisms of Photosensitized Oxidation“. Science. 162-jild, № 3857. 963–970-bet. Bibcode:1968Sci...162..963F. doi:10.1126/science.162.3857.963. Manba xatosi: Invalid
<ref>tag; name "foote-1968" defined multiple times with different content - ↑ 4,0 4,1 4,2 4,3 4,4 I. J. MacDonald, and T. J. Dougherty (2001). „Basic principles of photodynamic therapy“. Journal of Porphyrins and Phthalocyanines. 5-jild, № 2. 105–129-bet. doi:10.1002/jpp.328. Manba xatosi: Invalid
<ref>tag; name "macdonald-2001" defined multiple times with different content - ↑ Most of the recent (post-2000) literature includes the "Type III" classification; however, older articles only recognize Type I and Type II as named classes of photooxygenation reactions.
- ↑ C.S. Foote. Type I and Type II Mechanisms of Photodynamic Action, 1987 — 22–38 bet. DOI:10.1021/bk-1987-0339.ch002. ISBN 978-0-8412-1026-4.
- ↑ Mirbach, Marlis; M. Manfred; A. Saus (1982). „High-pressure photochemistry and ultraviolet spectroscopy in gas–liquid systems“. Chemical Reviews. 82-jild, № 1. 59–76-bet. doi:10.1021/cr00047a003.
- ↑ Stork, Gilbert; P. Sher; H. Chen (October 1986). „Radical Cyclization-Trapping in the Synthesis of Natural Products. A Simple, Stereocontrolled Route to Prostaglandin Fza“. J. Am. Chem. Soc. 108-jild, № 20. 6384–6385-bet. doi:10.1021/ja00280a043.
- ↑ Li, Yun; H. Hu; J. Ye; H. Fun; H. Hu; J. Xu (2004). „Reaction modes and mechanism in indolizine photooxygenation reactions“. Journal of Organic Chemistry. 69-jild, № 7. 2332–2339-bet. doi:10.1021/jo035070d.
- ↑ 10,0 10,1 Rumbach, edited by Jochen Mattay and Axel G. Griesbeck in cooperation with Christian Stammel, Joachim Hirt and Thomas. Photochemical key steps in organic synthesis : an experimental course book Jochen Mattay and Axel Griesbeck: . Weinheim: VCH, 1994. ISBN 978-3-527-29214-1. Manba xatosi: Invalid
<ref>tag; name "rumbach-1994" defined multiple times with different content - ↑ Adam, Waldemar; W. Bruenker (1993). „Diastereoselective and regioselective photooxygenation of a chiral allylic amine and its acyl derivatives: stereochemical evidence for a steering effect by the amino group in the ene reaction of singlet oxygen“. J. Am. Chem. Soc. 115-jild, № 7. 3008–3009-bet. doi:10.1021/ja00060a072.
- ↑ Dougherty, Thomas (May 1987). „Photosensitizers: therapy and detection of malignant tumors“. Photochemistry and Photobiology. 45-jild, № 445. 879–889-bet. doi:10.1111/j.1751-1097.1987.tb07898.x.
- ↑ Chen, Qun; Z. Huang; H. Chen; H. Shapiro; J. Beckers; F. Hetzel (August 2002). „Improvement of Tumor Response by Manipulation of Tumor Oxygenation During Photodynamic Therapy“. Photochemistry and Photobiology. 76-jild, № 2. 197–203-bet. doi:10.1562/0031-8655(2002)0760197IOTRBM2.0.CO2.

![{\displaystyle {\ce {Sens->[hv]{^{1}Sens^{\ast }}->{^{3}Sens^{\ast }}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6215cad829b7f70ab6da195d2ccda72164afd506)

