Statsionar va nostatsionar holat
Statsionar holat — bu vaqtga bogʻliq boʻlmagan barcha kuzatilishi mumkin boʻlgan kvant holati. Bu energiya operatorining xos vektori (turli energiyalarning kvant superpozitsiyasi oʻrniga). Yana, energiya oʻz vektori, energiya oʻz holati, energiya oʻz funksiyasi yoki energiya oʻz-oʻzidan deb ataladi. Bu kimyodagi atom orbita va molekulyar orbita tushunchasiga juda oʻxshaydi, baʼzi bir kichik farqlar quyida tushuntiriladi.
Nazariy qism[tahrir | manbasini tahrirlash]
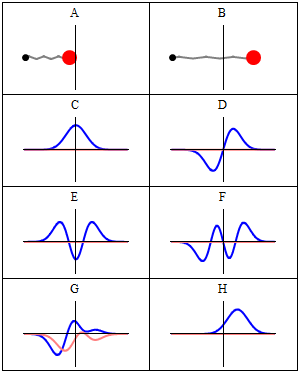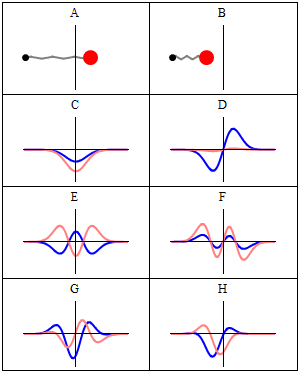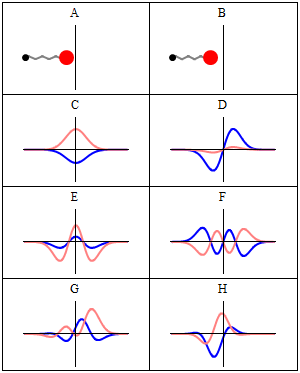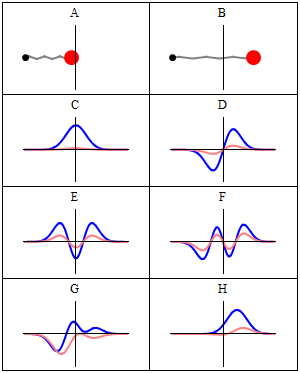
Statsionar holat statsionar deb ataladi, chunki tizim vaqt oʻtishi bilan har qanday kuzatilishi mumkin boʻlgan holatda oʻzgarmas qoladi. Bir zarrali Gamiltonian uchun bu zarracha oʻz pozitsiyasi, tezligi, spini va boshqalar uchun doimiy ehtimollik taqsimotiga ega ekanligini bildiradi. (Bu zarracha muhiti ham statsionar boʻlsa, yaʼni Gamiltonian vaqt boʻyicha oʻzgarmas boʻlsa, bu toʻgʻri) Toʻlqin funksiyasining oʻzi statsionar emas: u doimiy ravishda oʻzining umumiy kompleks faza omilini oʻzgartirib turadi, shunday qilib doimiy toʻlqin hosil qiladi. Doimiy toʻlqinning tebranish chastotasi, Plank doimiysi, Plank-Eynshteyn munosabatlariga koʻra holatning energiyasidir.
Statsionar holatlar — bu vaqtga bogʻliq boʻlmagan Shredinger tenglamasining yechimi boʻlgan kvant holatlar:
bu yerda
- kvant holati, bu tenglamani qanoatlantirsa, statsionar holat boʻladi;
- Gamilton operatori ;
- haqiqiy son va jarayonning energiya xos qiymatiga mos keladi .
Ushbu xos qiymat tenglamasi: vektor fazoda chiziqli operator, ning xos vektori hisoblanadi va uning xos qiymati hisoblanadi.
Agar statsionar holat boʻlsa vaqtga bogʻliq Shredinger tenglamasiga ulangan boʻlsa, natija:
Buni taxmin qilsak vaqtga bogʻliq emas (vaqt boʻyicha oʻzgarmas), bu tenglama istalgan vaqt — t uchun amal qiladi. Shuning uchun, bu qanday qilib tasvirlangan differentsial tenglama vaqtga qarab farqlanadi. Uning yechimi:
Shu sababli, statsionar holat — bu umumiy kompleks faza omili bilan tebranadigan doimiy toʻlqin va uning tebranish burchak chastotasini topish uchun uning energiyasi ga boʻlinadi.
Statsionar holat xususiyatlari[tahrir | manbasini tahrirlash]

Yuqorida koʻrsatilganidek, statsionar holat matematik jihatdan doimiy emas:
Biroq, jarayonning barcha kuzatiladigan xususiyatlari, aslida, vaqt ichida doimiydir. Masalan, agar oddiy bir oʻlchovli bir zarrachali toʻlqin funksiyasini ifodalaydi , zarrachaning x joyida boʻlish ehtimoli
t vaqtga bogʻliq emas.
Geyzenberg tasavvuri kvant mexanikasining alternativ matematik formulasi boʻlib, unda statsionar holatlar haqiqatan ham vaqt boʻyicha matematik jihatdan doimiydir.
Yuqorida aytib oʻtilganidek, bu tenglamalar Gamiltonian vaqtga bogʻliq emasligi taxmin qilinadi. Bu shuni anglatadiki, statsionar holatlar faqat tizimning qolgan qismi ham oʻzgarmas va statsionar boʻlganda tizim statsionar boʻladi. Masalan, vodorod atomidagi 1s elektron statsionar holatda, lekin agar vodorod atomi boshqa atom bilan reaksiyaga kirishsa, u holda elektron albatta buziladi, statsionar holat boʻlmaydi.
Spontan parchalanish[tahrir | manbasini tahrirlash]
Spontan parchalanish statsionar holatlar haqidagi savolni murakkablashtiradi. Masalan, oddiy (relativistik boʻlmagan) kvant mexanikasiga koʻra, vodorod atomi juda koʻp statsionar holatlarga ega: 1s, 2s, 2p va h.k. Barchasi statsionar holatlardir. Biroq, aslida, faqat asosiy holat 1s haqiqatan ham „statsionar“: yuqori energiya darajasidagi elektron asosiy holatga parchalanish uchun oʻz-oʻzidan bir yoki bir nechta fotonlarni chiqaradi. Bu statsionar holatlar oʻzgarmas xususiyatlarga ega boʻlishi kerak degan fikrga zid koʻrinadi.
Izoh shundan iboratki, relyativistik boʻlmagan kvant mexanikasida qoʻllaniladigan Gamiltonian kvant maydon nazariyasidan Gamiltonianga yaqinroqdir. Yuqori energiyali elektron holatlar (2s, 2p, 3s va boshqalar) taxminiy Gamiltonian boʻyicha statsionar holatlardir, lekin vakuum tebranishlari tufayli haqiqiy Gamiltonian boʻyicha statsionar holatlar mavjud emas. Yana bir tomondan, 1-holat ham taxminiy, ham haqiqiy Gamiltonianga koʻra haqiqatda statsionar holatdir.
Kimyoda „orbita“ bilan taqqoslash[tahrir | manbasini tahrirlash]
Orbital — bir elektronli atom yoki molekulaning statsionar holati (yoki uning yaqinlashishi) aniqroq aytganda, atomdagi elektron uchun atom orbitali yoki molekuladagi elektron uchun molekulyar orbital.
Faqat bitta elektronni oʻz ichiga olgan molekula uchun (masalan, vodorod atomi) orbita molekulaning umumiy statsionar holatiga toʻliq mos keladi. Biroq, koʻp elektronli molekula uchun orbita umumiy statsionar holatdan butunlay farq qiladi, bu koʻp zarrachali holat boʻlib, murakkabroq tavsifni talab qiladi (masalan, Sleyter determinanti). Xususan, koʻp elektronli molekulada orbita molekulaning umumiy statsionar holati emas, balki molekula ichidagi bitta elektronning statsionar holatidir. Orbitaning bu konsepsiyasi, agar Gamiltoniandagi elektron-elektron taʼsirli itarilish shartlarini soddalashtiruvchi taxmin sifatida eʼtiborsiz qoldiradigan boʻlsak, koʻp elektronli molekulaning umumiy xos vektorini alohida elektron statsionar holatlardan alohida hissalarga ajratishimiz mumkinligi haqidagi taxminiy maʼnoga ega. (orbitallar), ularning har biri bir elektronli yaqinlashuv ostida olinadi. (Yaxshiyamki, kimyogarlar va fiziklar koʻpincha lekin har doim ham emas bu „bir elektronli yaqinlashish“ dan foydalanishlari mumkin) Shu maʼnoda koʻp elektronli sistemada orbitalni sistemadagi alohida elektronning statsionar holati deb hisoblash mumkin.
Kimyoda molekulyar orbitalarni hisoblash odatda Born-Oppengeymer yaqinlashuvini ham qabul qiladi.
Manbalar[tahrir | manbasini tahrirlash]
- G.Ahmedova „Atom fizikasi“
- R.Bekjonov „Atom va yadro fizikasi“
- Ingliz tilidagi manba
Bu maqola birorta turkumga qoʻshilmagan. Iltimos, maqolaga aloqador turkumlar qoʻshib yordam qiling. (Aprel 2024) |











