Olmosdagi kristallografik nuqsonlar

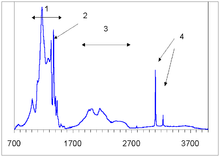
Olmosning kristall panjarasidagi nuqsonlar tez-tez uchraydi. Bunday nuqsonlar olmos oʻsish vaqtida yoki undan keyin panjaraga kiritilgan tartibsizliklar yoki tashqi oʻrnini bosuvchi yoki interstitsial aralashmalar natijasida yuzaga keladi. Nuqsonlar olmosning moddiy xususiyatlariga taʼsir qiladi va olmosning qaysi turiga tegishli ekanligini aniqlaydi; eng asosiy taʼsiri olmosning rangiga va elektr oʻtkazuvchanlikka boʻladi
Nuqsonlarni turli xil spektroskopiya turlari, jumladan elektron paramagnit rezonans (EPR), yorugʻlik yoki elektron nurlar tomonidan induktsiya qilingan luminesans va spektrning infraqizil, koʻrinadigan va UV qismlarida yorugʻlikning yutilishi bilan aniqlash mumkin. Absorbsiya spektri nafaqat nuqsonlarni aniqlash, balki ularning konsentratsiyasini baholash uchun ham qoʻllaniladi; tabiiyni sintetik yoki rivojlangan olmoslardan ham ajrata oladi[1].
Olmos markazlarini etiketlash[tahrir | manbasini tahrirlash]
Olmos spektroskopiyasida nuqsonli spektrni raqamlangan qisqartmalar bilan belgilash odatga aylangan (masalan, GR1). Bu anʼanaga, odatda, A, B va C markazlari kabi sezilarli ogʻishlar bilan amal qilingan. Koʻpgina qisqartmalar chalkash boʻlsa-da quyidagi xossalarga ega:[2]
- Baʼzi belgilar juda oʻxshash (masalan, 3H va H3).
- Tasodifan, EPR va optik usullar bilan aniqlangan turli markazlarga bir xil teglar berildi (masalan, N3 EPR markazi va N3 optik markazning aloqasi yoʻq)[3].
- Baʼzi qisqartmalar mantiqiy boʻlsa-da, masalan, N3 (N tabiiy, yaʼni tabiiy olmosda kuzatiladi) yoki H3 (H isitiladi, yaʼni nurlanish va isitishdan keyin kuzatiladi), koʻpchilik bunday emas. Xususan, UN (umumiy nurlanish), N (nurlanish) va IN (II turdagi nurlanish) yorliqlarining maʼnosi oʻrtasida aniq farq yoʻq[2].
Nuqson simmetriyasi[tahrir | manbasini tahrirlash]
Kristallardagi nuqsonlar simmetriyasini nuqtaviy guruhlari bilan tavsiflash mumkin. Ular kristallarning simmetriyasini tavsiflovchi fazoviy guruhlardan translatsiyaning yoʻqligi bilan ajralib turadi va shuning uchun ularning soni kamroq. Olmosda hozirgacha faqat quyidagi simmetriyalarning nuqsonlari kuzatilgan: tetraedral (T d), tetragonal (D 2d), trigonal (D 3d, C 3v), rombik (C 2v), monoklinik (C 2h, C 1h, C 2) va triklinik (C 1 yoki C S)[2][4].
Nuqsonlar simmetriyasi koʻplab optik xususiyatlarni oldindan aytish imkonini beradi. Masalan, sof olmos panjarasida bitta fononli (infraqizil) yutilish sodir boʻlmaydi, chunki panjara inversiya markaziga ega. Biroq, har qanday nuqsonning kiritilishi (hatto „juda simmetrik“, masalan, NN oʻrnini bosuvchi juftlik) kristal simmetriyasini buzadi, bu esa olmosdagi nuqson kontsentratsiyasini oʻlchash uchun eng keng tarqalgan vosita boʻlgan nuqsonli infraqizil yutilishga olib keladi[2].
Yuqori bosimli yuqori haroratli sintez[5] yoki kimyoviy bugʻ choʻktirish usuli bilan oʻstirilgan sintetik olmosda[6][7] simmetriya tetraedraldan past boʻlgan nuqsonlar oʻsish yoʻnalishiga toʻgʻri keladi. Bunday hizalanish galliy arsenidida ham kuzatilgan[8] va shuning uchun olmosga xos emas.
Tashqi nuqsonlar[tahrir | manbasini tahrirlash]
Olmosni turli xil elementar tahlil qilish orqalr uning tarkibida boshqa turdagi aralashmalarni aniqlash mumkin[9]. Biroq, ular asosan olmos tarkibiga nanometr darajasida kichik boʻlgan va optik mikroskopda koʻrinmas boʻlgan begona materiallarning qoʻshilishidan kelib chiqadi. Bundan tashqari, deyarli har qanday elementni ion implantatsiyasi orqali olmosga kiritish mumkin. Olmos oʻsishi jarayonida izolyatsiyalangan atomlar (yoki kichik atom klasterlari) sifatida olmos panjarasiga kiritilishi mumkin boʻlgan elementlar muhimroqdir. 2008-yilga kelib, bu element sifatida azot, bor, vodorod, kremniy, fosfor, nikel, kobalt va oltingugurt ishlatilgan. Marganes[10] va volfram [11] ham olmos tarkibida aniq aniqlangan, ammo ular begona qoʻshimchalardan kelib chiqishi mumkin. Olmosda izolyatsiyalangan temirning aniqlanishi[12] keyinchalik olmos sintezi jarayonida hosil boʻlgan yoqutning mikro-zarralari nuqtai nazaridan qayta talqin qilindi. [13] Kislorod ham olmosning asosiy nosogligiga sabab boʻladi deb ishoniladi[14], ammo u hali olmosda spektroskopik jihatdan aniqlanmagan. Ikki elektron paramagnit rezonans markazlari (OK1 va N3) dastlab azot-kislorod komplekslariga, keyinroq titan bilan bogʻliq komplekslarga tayinlangan. [15] Biroq, tayinlash bilvosita va tegishli konsentratsiyalar juda past (millionga bir necha qism). [16]
Azot[tahrir | manbasini tahrirlash]
Olmosdaning sofligini buzuvchi, eng keng tarqalgan nosoflik azot boʻlib, u massa boʻyicha olmosning 1 % gacha boʻlishi mumkin[14]. Ilgari olmosdagi barcha panjara nuqsonlari olmos strukturasining anomaliyalarning natijasi deb hisoblangan. Biroq, keyingi tadqiqotlar azotning koʻpgina olmoslarda va turli xil konfiguratsiyalarda mavjudligini aniqladi. Azotning koʻp qismi olmos panjarasiga bitta atom sifatida kiradi (yaʼni azot oʻz ichiga olgan molekulalar qoʻshilishdan oldin ajralib chiqadi), shuningdek, molekulyar azot olmosga kirishi mumkin[17].
Olmosning yorugʻlikni yutish xossasi va boshqa moddiy xususiyatlari uning tarkibidagi azotning agregatsiya holatiga juda bogʻliq. Garchi barcha agregat konfiguratsiyalar infraqizil nurda soʻrilishini keltirib chiqarsa ham, yigʻilgan azotni oʻz ichiga olgan olmoslar odatda rangsiz boʻlib, kam hollarda koʻrinadigan spektrda ozgina soʻrilishga ega.[2]. Toʻrtta asosiy azot shakllari quyidagilardir:
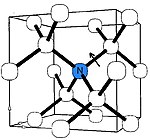
C-azot markazi[tahrir | manbasini tahrirlash]
C markazi olmos panjarasidagi elektr neytral yagona oʻrnini bosuvchi azot atomlariga mos keladi. Bular elektron paramagnit rezonans spektrlarida oson koʻrinadi [18] (bu yerda ular tushunarsiz boʻlsada, P1 markazlari deb ataladi). C markazlari chuqur sariqdan jigarrang rangga ega; bu olmoslar Ib turiga kiradi va odatda marvarid shaklida kam uchraydigan „kanareyka olmoslari“ deb nomlanadi. Yuqori bosimli yuqori haroratli (YBYH) texnikasi bilan ishlab chiqarilgan koʻpgina sintetik olmoslar C shaklida yuqori darajadagi azotni oʻz ichiga oladi; azot nosofligi atmosferadan yoki grafit manbasidan kelib chiqadi. 100 000 uglerod atomiga bitta azot atomi toʻgʻri kelganda olmos sariq rang hosil qiladi. Azot atomlarida beshta elektron mavjud boʻlganligi sababli (ular oʻrnini bosadigan uglerod atomlaridan bitta koʻp) ular "chuqur donorlar " rolini oʻynaydi; yaʼni har bir oʻrnini bosuvchi azot uglerodga berish uchun qoʻshimcha elektronga ega. ~2,2 eV dan yuqori energiyali yorugʻlik donor elektronlarini oʻtkazuvchanlik zonasiga qoʻzgʻatishi mumkin, natijada sariq rang paydo boʻladi[19].
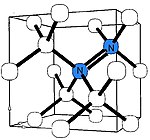
A-azot markazi[tahrir | manbasini tahrirlash]
A markazi, tabiiy olmoslarning eng keng tarqalgan nuqsonidir. U uglerod atomlari oʻrnini bosuvchi azot atomlarining neytral yaqin qoʻshni juftligidan iborat. A markazi ~4 eV (310 nm, yaʼni koʻzga koʻrinmas) va shuning uchun rang berishni keltirib chiqarmaydi. Asosan A shaklida azot oʻz ichiga olgan olmos IaA turiga kiradi [20].
A-markazi diamagnitdir, lekin agar ultrabinafsha nurlar yoki chuqur akseptorlar tomonidan ionlangan boʻlsa, u W24 elektron paramagnit rezonans spektrini hosil qiladi, uning tahlili N=N tuzilishini aniq tasdiqlaydi[21].
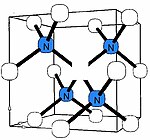
B-azot markazi[tahrir | manbasini tahrirlash]
B-markazi (baʼzan B1 deb ataladi) uglerod atomlari oʻrnini bosuvchi toʻrtta azot atomi bilan oʻralgan uglerod boʻshligʻidan iborat degan umumiy konsensus mavjud[1][2][22]. Ushbu nuqson turi model boʻlib, boshqa eksperimental natijalarga mos keladi, ammo uni tasdiqlovchi toʻgʻridan-toʻgʻri spektroskopik maʼlumotlar yoʻq. Koʻplab B-azot markazlarini hosil qiladigan olmoslar kam uchraydi va IaB turi sifatida tasniflanadi; eng qimmatbaho olmoslar N3 markazlari bilan birga A va B markazlarining aralashmasini oʻz ichiga oladi.
Bor[tahrir | manbasini tahrirlash]
Panjarada oʻrnini bosuvchi aralashma sifatida Bor atomini oʻz ichiga oluvchi olmoslar IIb turi deb ataladi. Tabiiy olmoslarning faqat bir foizi bu turga kiradi va ularning aksariyati koʻkdan kulranggacha boʻlgan ranglarni hosil qiladi[23]. Bor olmosda akseptor hisoblanadi: bor atomlarida uglerod atomlariga qaraganda bitta kamroq elektron mavjud; shuning uchun uglerod atomini almashtirgan har bir bor atomi tarmoqli boʻshligʻida valentlik zonasidan elektronni qabul qila oladigan elektron kovak hosil qiladi. Bu qizil nurni singdirish imkonini beradi va elektronning valentlik zonasini tark etishi uchun zarur boʻlgan kichik energiya (0,37 eV)[24] tufayli, xona haroratida ham bor atomlaridan valentlik zonasiga kovaklar termal ravishda chiqarilishi mumkin. Ushbu kovaklar elektr maydonida harakatlanishi va olmosni elektr o'tkazuvchanligi (yaʼni, p-tipli yarimoʻtkazgich) qilishi mumkin. Buning uchun olmosga juda oz miqdordagi bor atomlarini kiritish talab qilinadi — odatiy nisbat 1 000 000 uglerod atomiga bitta bor atomi yetarli boʻladi.
Fosfor[tahrir | manbasini tahrirlash]
Fosforni ~ 0,01 % gacha konsentratsiyalarda kimyoviy bugʻlarni choʻktirish (CVD) orqali oʻstirilgan olmosga ataylab kiritish mumkin[25]. Fosfor olmos panjarasida uglerod oʻrnini bosadi[26]. Azotga oʻxshab, fosforda ugleroddan bitta elektron koʻp va shuning uchun fosfor donor sifatida ishlaydi; ammo fosforning ionlanish energiyasi (0,6 eV)[25] azotnikidan (1,7 eV)[27] ancha kichik va xona haroratida termal ionlanish uchun yetarlicha kichikdir. Olmosdagi fosforning bu muhim xususiyati UB yorugʻlik chiqaradigan diodlar (LEDlar, 235 nm da) kabi elektron qurilmalar ishlab chiqarishga juda qoʻl keladi[28].
Vodorod[tahrir | manbasini tahrirlash]
Vodorod yarimoʻtkazgichlarda, shu jumladan olmosdagi eng muhim texnologik aralashmalardan biridir. Vodorod bilan bogʻliq nuqsonlar tabiiy olmosda va sintetik olmos plyonkalarida juda farq qiladi. Ushbu plyonkalar vodorodga boy atmosferada (odatiy vodorod/uglerod nisbati >100) turli xil kimyoviy bugʻlarni choʻktirish (CVD) usullari bilan plazma ionlari tomonidan oʻsib borayotgan olmosni kuchli bombardimon qilish ostida ishlab chiqariladi. Natijada, CVD usulida olingan olmos har doim vodorod va panjara boʻsh joylariga boy. Polikristal plyonkalarda vodorodning katta qismi olmos „donalari“ orasidagi chegarada yoki olmos boʻlmagan uglerod birikmalarida joylashgan boʻlishi mumkin. Olmos panjarasining oʻzida vodorod-vakansiya[29] va vodorod-azot-vakansiya[30] komplekslari elektron paramagnit rezonansi orqali manfiy zaryad holatlarida aniqlanadi. Bundan tashqari, vodorod bilan bogʻliq koʻplab IQ yutilish choʻqqilari tajribalarda aniqlangan[31].
Yana qarang[tahrir | manbasini tahrirlash]
Manbalar[tahrir | manbasini tahrirlash]
- ↑ 1,0 1,1 Collins, A. T. (2003). "The detection of colour-enhanced and synthetic gem diamonds by optical spectroscopy". Diamond and Related Materials 12 (10–11): 1976–1983. doi:10.1016/S0925-9635(03)00262-0.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Walker, J. (1979). "Optical absorption and luminescence in diamond". Reports on Progress in Physics 42 (10): 1605–1659. doi:10.1088/0034-4885/42/10/001. https://accreditedgemologists.org/lightingtaskforce/OpticalAbsorptionand.pdf.
- ↑ Wyk, J. A. V. (1982). "Carbon-12 hyperfine interaction of the unique carbon of the P2 (ESR) or N3 (optical) centre in diamond". Journal of Physics C: Solid State Physics 15 (27): L981–L983. doi:10.1088/0022-3719/15/27/007.
- ↑ Zaitsev, A. M.. Optical Properties of Diamond : A Data Handbook. Springer, 2001. ISBN 978-3-540-66582-3.
- ↑ Iakoubovskii, K.; Collins, A. T. (2004). "Alignment of Ni- and Co-related centres during the growth of high-pressure–high-temperature diamond". Journal of Physics: Condensed Matter 16 (39): 6897. doi:10.1088/0953-8984/16/39/022. https://www.researchgate.net/publication/230954924.
- ↑ Edmonds, A.; d’Haenens-Johansson, U.; Cruddace, R.; Newton, M.; Fu, K. -M.; Santori, C.; Beausoleil, R.; Twitchen, D. et al. (2012). "Production of oriented nitrogen-vacancy color centers in synthetic diamond". Physical Review B 86 (3): 035201. doi:10.1103/PhysRevB.86.035201.
- ↑ d’Haenens-Johansson, U.; Edmonds, A.; Newton, M.; Goss, J.; Briddon, P.; Baker, J.; Martineau, P.; Khan, R. et al. (2010). "EPR of a defect in CVD diamond involving both silicon and hydrogen that shows preferential alignment". Physical Review B 82 (15): 155205. doi:10.1103/PhysRevB.82.155205.
- ↑ Hogg, R. A.; Takahei, K.; Taguchi, A.; Horikoshi, Y. (1996). "Preferential alignment of Er–2O centers in GaAs:Er,O revealed by anisotropic host-excited photoluminescence". Applied Physics Letters 68 (23): 3317. doi:10.1063/1.116043.
- ↑ Assali, L. V. C.; Machado, W. V. M.; Justo, J. F. (2011). "3d transition metal impurities in diamond: electronic properties and chemical trends". Phys. Rev. B 84 (15): 155205. doi:10.1103/PhysRevB.84.155205.
- ↑ Iakoubovskii, K.; Stesmans, A. (2001). "Characterization of Defects in as-Grown CVD Diamond Films and HPHT Diamond Powders by Electron Paramagnetic Resonance". Physica Status Solidi A 186 (2): 199. doi:10.1002/1521-396X(200108)186:2<199::AID-PSSA199>3.0.CO;2-R. https://www.researchgate.net/publication/243596989.
- ↑ Lal, S.; Dallas, T.; Yi, S.; Gangopadhyay, S.; Holtz, M.; Anderson, F. (1996). "Defect photoluminescence in polycrystalline diamond films grown by arc-jet chemical-vapor deposition". Physical Review B 54 (19): 13428–13431. doi:10.1103/PhysRevB.54.13428. PMID 9985239.
- ↑ Iakoubovskii, K.; Adriaenssens, G. J. (2002). "Evidence for a Fe-related defect centre in diamond". Journal of Physics: Condensed Matter 14 (4): L95. doi:10.1088/0953-8984/14/4/104. https://www.researchgate.net/publication/231021050.
- ↑ Iakoubovskii, K.; Adriaenssens, G. J. (2002). "Comment on 'Evidence for a Fe-related defect centre in diamond'". Journal of Physics: Condensed Matter 14 (21): 5459. doi:10.1088/0953-8984/14/21/401. https://www.researchgate.net/publication/243411401.
- ↑ 14,0 14,1 Kaiser, W.; Bond, W. (1959). "Nitrogen, A Major Impurity in Common Type I Diamond". Physical Review 115 (4): 857. doi:10.1103/PhysRev.115.857.
- ↑ Czelej, K.; Ćwieka, K.; Śpiewadoi, Piotr; Kurzydłowskia, Krzysztof Jan (2018). "Titanium-related color centers in diamond: a density functional theory prediction". J. Mater. Chem. C 6 (19): 5261-5268. https://pubs.rsc.org/en/content/articlehtml/2018/tc/c8tc00097b.
- ↑ Newton, M. E.; Baker, J. M. (1989). "14N ENDOR of the OK1 centre in natural type Ib diamond". Journal of Physics: Condensed Matter 1 (51): 10549. doi:10.1088/0953-8984/1/51/024.
- ↑ Iakoubovskii, K.; Adriaenssens, G. J.; Vohra, Y. K. (2000). "Nitrogen incorporation in diamond films homoepitaxially grown by chemical vapour deposition". Journal of Physics: Condensed Matter 12 (30): L519. doi:10.1088/0953-8984/12/30/106. https://www.researchgate.net/publication/231100286.
- ↑ Smith, W.; Sorokin, P.; Gelles, I.; Lasher, G. (1959). "Electron-Spin Resonance of Nitrogen Donors in Diamond". Physical Review 115 (6): 1546. doi:10.1103/PhysRev.115.1546.
- ↑ Iakoubovskii, K.; Adriaenssens, G. J. (2000). "Optical transitions at the substitutional nitrogen centre in diamond". Journal of Physics: Condensed Matter 12 (6): L77. doi:10.1088/0953-8984/12/6/102. https://www.researchgate.net/publication/258290449.
- ↑ Davies, G. (1976). "The A nitrogen aggregate in diamond-its symmetry and possible structure". Journal of Physics C: Solid State Physics 9 (19): L537–L542. doi:10.1088/0022-3719/9/19/005.
- ↑ Tucker, O.; Newton, M.; Baker, J. (1994). "EPR and N14 electron-nuclear double-resonance measurements on the ionized nearest-neighbor dinitrogen center in diamond". Physical Review B 50 (21): 15586–15596. doi:10.1103/PhysRevB.50.15586. PMID 9975922.
- ↑ Collins, A. T. (1999). "Things we still don't know about optical centres in diamond". Diamond and Related Materials 8 (8–9): 1455–1462. doi:10.1016/S0925-9635(99)00013-8.
- ↑ OʻDonoghue, M. (2002) „Synthetic, imitation & treated gemstones“, Elsevier Butterworth-Heinemann, Great Britain. ISBN 0-7506-3173-2, p. 52
- ↑ Collins, A. T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences 342 (1664): 233–244. doi:10.1098/rsta.1993.0017.
- ↑ 25,0 25,1 Kociniewski, T.; Barjon, J.; Pinault, M. -A.; Jomard, F.; Lusson, A.; Ballutaud, D.; Gorochov, O.; Laroche, J. M. et al. (2006). "N-type CVD diamond doped with phosphorus using the MOCVD technology for dopant incorporation". Physica Status Solidi A 203 (12): 3136. doi:10.1002/pssa.200671113.
- ↑ Hasegawa, M.; Teraji, T.; Koizumi, S. (2001). "Lattice location of phosphorus in n-type homoepitaxial diamond films grown by chemical-vapor deposition". Applied Physics Letters 79 (19): 3068. doi:10.1063/1.1417514.
- ↑ Farrer, R. G. (1969). "On the substitutional nitrogen donor in diamond". Solid State Communications 7 (9): 685–688. doi:10.1016/0038-1098(69)90593-6.
- ↑ Koizumi, S.; Watanabe, K.; Hasegawa, M.; Kanda, H. (2001). "Ultraviolet Emission from a Diamond pn Junction". Science 292 (5523): 1899–1901. doi:10.1126/science.1060258. PMID 11397942.
- ↑ Glover, C.; Newton, M. E.; Martineau, P. M.; Quinn, S.; Twitchen, D. J. (2004). "Hydrogen incorporation in diamond: The vacancy-hydrogen complex". Physical Review Letters 92 (13): 135502. doi:10.1103/PhysRevLett.92.135502. PMID 15089622.
- ↑ Glover, C.; Newton, M.; Martineau, P.; Twitchen, D.; Baker, J. (2003). "Hydrogen Incorporation in Diamond: The Nitrogen-Vacancy-Hydrogen Complex". Physical Review Letters 90 (18): 185507. doi:10.1103/PhysRevLett.90.185507. PMID 12786024.
- ↑ Fuchs, F.; Wild, C.; Schwarz, K.; MüLler-Sebert, W.; Koidl, P. (1995). "Hydrogen induced vibrational and electronic transitions in chemical vapor deposited diamond, identified by isotopic substitution". Applied Physics Letters 66 (2): 177. doi:10.1063/1.113126.
